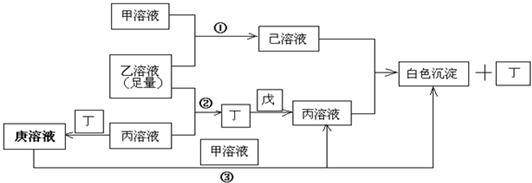
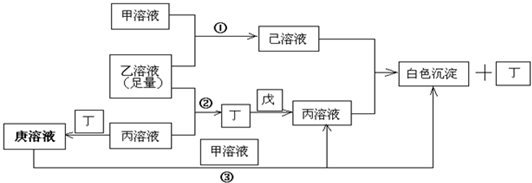
解:常见A、B、C、D四种短周期元素,甲、乙、丙是3种含氧酸的B盐,其焰色反应均呈黄色,故B为Na元素.戊为淡黄色固体,与气体丁反应,生成含氧酸盐钠丙,故淡黄色固体戊为过氧化钠,气体丁为二氧化碳,丙为碳酸钠,A元素原子最外层电子数比B多三个,A原子最外层电子数为4,丙(碳酸钠)中含A元素,故A为碳元素.含氧酸钠盐甲中含C元素,甲溶液pH>7,则C为铝元素,钠盐甲为偏铝酸钠,C元素原子最外层电子数是D元素原子最外层电子数的一半,故D元素最外层电子数为6,原子序数大于铝元素,则D为硫元素,钠盐乙为硫酸氢钠,乙溶液pH<7,代入关系图验证符合,
故A为C元素;B为Na元素,C为Al元素,D为S元素;甲为偏铝酸钠,乙为硫酸氢钠,丙为碳酸钠,丁为二氧化碳,戊为过氧化钠,己为硫酸铝,庚为碳酸氢钠,
(1)D为硫元素,原子核外有16个电子,有3个电子层,最外层电子数为6,原子结构示意图为

;戊为过氧化钠,由钠离子与过氧根离子构成,电子式为
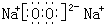
,
故答案为:

;
;
(2)丙为碳酸钠,是强碱弱酸盐,CO
32-水解CO
32-+H
2O?HCO
3-+OH
-,使溶液呈碱性,故答案为:CO
32-水解使溶液呈碱性;
(3)①甲为偏铝酸钠、乙为硫酸氢钠,硫酸氢钠足量,二者在溶液中发生反应,生成硫酸铝、硫酸钠与水,反应离子方程式为AlO
2-+4H
+=Al
3++2H
2O,故答案为:AlO
2-+4H
+=Al
3++2H
2O;
②乙为硫酸氢钠,丙为碳酸钠,硫酸氢钠与碳酸钠反应,生成硫酸钠、二氧化碳与水,反应离子方程式为2H
++CO
32-=H
2O+CO
2↑,故答案为:2H
++CO
32-=H
2O+CO
2↑;
③丁为二氧化碳,丙为碳酸钠,在溶液中,二者反应生成碳酸氢钠,所以庚溶液为碳酸氢钠溶液,甲为偏铝酸钠,碳酸氢钠与偏铝酸钠在溶液中发生反应,生成氢氧化铝沉淀与碳酸钠,反应离子方程式为HCO
3-+AlO
2-+H
2O=CO
32-+Al(OH)
3↓,反应中碳酸氢钠提供氢离子,故酸性碳酸氢根>氢氧化铝,所以偏铝酸钠溶液碱性强于和庚碳酸氢钠溶液的碱性,
故答案为:HCO
3-+AlO
2-+H
2O=CO
32-+Al(OH)
3↓;>.
分析:常见A、B、C、D四种短周期元素,甲、乙、丙是3种含氧酸的B盐,其焰色反应均呈黄色,故B为Na元素.戊为淡黄色固体,与气体丁反应,生成含氧酸盐钠丙,故淡黄色固体戊为过氧化钠,气体丁为二氧化碳,丙为碳酸钠,A元素原子最外层电子数比B多三个,A原子最外层电子数为4,丙(碳酸钠)中含A元素,故A为碳元素.含氧酸钠盐甲中含C元素,甲溶液pH>7,则C为铝元素,钠盐甲为偏铝酸钠,C元素原子最外层电子数是D元素原子最外层电子数的一半,故D元素最外层电子数为6,原子序数大于铝元素,则D为硫元素,钠盐乙为硫酸氢钠,乙溶液pH<7,代入关系图验证符合,据此解答.
点评:本题考查元素及化合物推断、离子方程式常用化学用语、盐类水解等,综合性较大,难度中等,推断物质是关键,根据淡黄色固体猜测然后进行验证.猜测验证法是元素化合物推断中经常用的方法.


 ;戊为过氧化钠,由钠离子与过氧根离子构成,电子式为
;戊为过氧化钠,由钠离子与过氧根离子构成,电子式为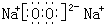 ,
, ;
;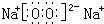 ;
;










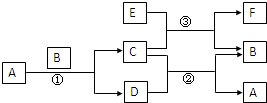 右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.