
 (Ⅰ) 水的电离平衡曲线如图所示.
(Ⅰ) 水的电离平衡曲线如图所示. | 10-12 |
| 10-7 |
| 10-4x-10-5y |
| x+y |


科目:高中化学 来源: 题型:
 某化学兴趣小组对原电池中盐桥的作用进行探究,并设计了以下实验装置:
某化学兴趣小组对原电池中盐桥的作用进行探究,并设计了以下实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mlHCL |
| NaOH |
| 100mlNaOH |
| HCL |
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
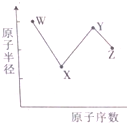 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| C、氧化铜与稀H2SO4反应:CuO+2H+=Cu2++H2O |
| D、金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义.
电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义. (R、R表示烃基)则该原电池的负极反应式为
(R、R表示烃基)则该原电池的负极反应式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑥ | B、①⑤⑥ |
| C、②③④ | D、①⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com