
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| c(HCN) |
| c(CN-) |
| c(CN-)×c(H+) |
| c(HCN) |
| c(HCN) |
| c(CN-) |
| c(CN-)×c(H+) |
| c(HCN) |
| c(HCN) |
| c(CN-) |
| c(H+) |
| K |
| 1×10-11 |
| 4.9×10-10 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、都比较稳定,密封放置不产生沉淀 |
| B、两分散系均有丁达尔现象 |
| C、加入盐酸先产生沉淀,随后溶解 |
| D、分散质微粒可通过半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、2:3 |
| C、2:7 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、红褐色液体为氢氧化铁胶体 |
| B、加入石灰石是为了促进氯化铁水解 |
| C、产生的气泡是HCl气体 |
| D、产生的气泡是CO2 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组为了探究电化学原理,设计了如图所示的电化学装置,电极Ⅰ为锌,其它电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液,下列叙述正确的是( )
某小组为了探究电化学原理,设计了如图所示的电化学装置,电极Ⅰ为锌,其它电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液,下列叙述正确的是( )| A、电子由电极Ⅳ通过外电路流向电极Ⅰ |
| B、装置工作过程中Ⅲ电极周围出现红色 |
| C、电极Ⅱ发生还原反应 |
| D、盐桥中Cl-向乙池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
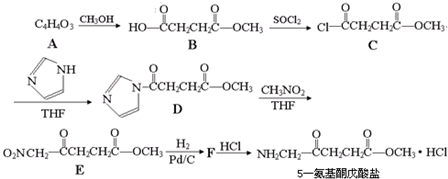
| H2 |
| Pd/C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com