
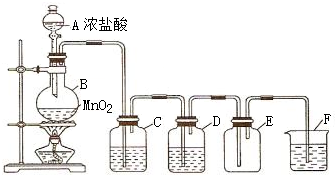
| ||
| ||
| 8.7g |
| 87g/mol |
| ||


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:阅读理解
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源:2012届高考化学一轮复习专题综合测试6:化学反应与能量变化(苏教版) 题型:填空题
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
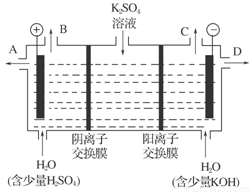
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。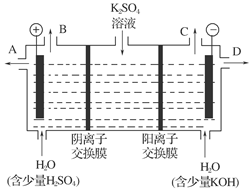
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011年山东省威海市高一下学期期末模块考试 题型:实验题
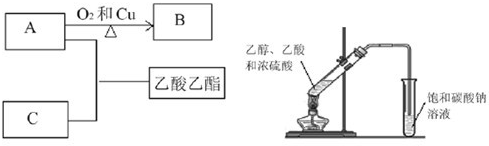
(15分)根据下图转化回答有关问题: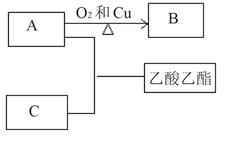
(1)①写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
②B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
①浓硫酸的作用是_______________ _______________。
②饱和碳酸钠溶液的主要作用_______________。
③装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
| A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水 |
| B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸 |
| C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸 |
| D.正反应的速率与逆反应的速率相等 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习专题综合测试6:化学反应与能量变化(苏教版) 题型:填空题
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com