
工业废水中常含有一定量的 Cr2O72-和 CrO42-,它们会对生态系统产生很大的伤害,工业上对废水处理的工艺流程如下
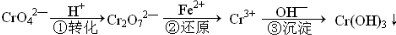
(1)CrO4中 Cr 的化合价 ;Cr3+的核外电子排布式为 。
(2)写出第①步发生的离子反应方程式 ;若常温下,减小平衡体系的 pH 至 pH=2,则溶液趋向于显 色。
(3)第②步中,还原 0.01mol Cr2O72-离子,需要 mol 的 FeSO4·7H2O
(4)已知 Cr(OH)3 在溶液中存在以下平衡:H++CrO2-+H2O  Cr(OH)3
Cr(OH)3 Cr3++3OH-下列有关说法中正确的是
Cr3++3OH-下列有关说法中正确的是
a.加 HCl 则平衡均向右移动,则生成 Cr3+盐
b.按照物质分类 Cr(OH)3 是两性氢氧化物,属于弱电解质
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生沉淀,后沉淀消失
d.Cr(OH)3 饱和溶液中一定有 c(H )=c(OH )
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:实验题
某大学实验室对煤矸石(主要含Al2O3、SiO2及Fe2O3)制备聚合氯化铝{[Al2(OH)nCl6-n]m}(1≤n≤5,m≤10),简称PAC,是一种新型、高效的絮凝剂和净水剂}。其工艺流程如下:
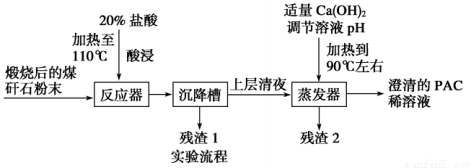
请回答下列问题:
(1)用浓盐酸配制20%的盐酸所需的玻璃仪器有______________________________。
(2)加20%的盐酸酸浸,有关反应的离子方程式为_____________________________。
(3)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原
Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL.已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平).判断滴定终点的依据____ ;
残渣2中铁元素的质量分数为 _ .
(4)由澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是_______________,得到的PAC粗产品中可能含有的杂质离子是____________。
(5)从不引入杂质的角度来考虑,调节溶液pH的试剂可改为________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
(6)若m=n=2,则生成PAC的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
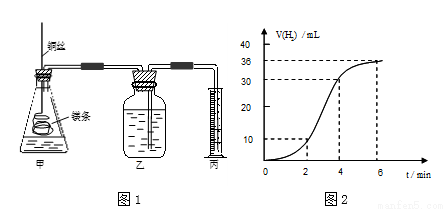
⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。

②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后 ,反应速率逐渐减慢,请简述其原_____________________________。
,反应速率逐渐减慢,请简述其原_____________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:______________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:_____________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中_____________,实验b中_________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
已知:CaCO3( s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
A.低温 B.高温
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度盐酸中,d比a反应激烈;将铜浸入b的盐溶液中,无明显变化;若将铜浸入c的盐溶液中,有金属c析出,据此判断它们的活动性由强到弱的顺序是( )
A.d>c>a>b B.d>a>b>c
C.d>b>a>c D.b>a>d>c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列有关问题,与盐的水解无关的是( )
A.NH4Cl 与 ZnCl2 溶液可作焊接金属中的除锈剂
B.用 NaHSO4 去除暖手瓶中的水垢
C.实验室盛放 Na2CO3 溶液的试剂瓶不能用磨口玻璃塞
D.加热蒸干 AlCl3 溶液得到 Al(OH)3 固体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
①N2+3H2 2NH3;②N2+O2
2NH3;②N2+O2 2NO
2NO
根据图中的数据判断下列说法正确的是 ( )
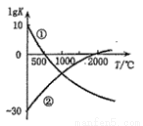
A.只有反应①是放热反应
B.升温,反应①的速率减小反应②的速率增大
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( ) 
A.容器I、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ
D.容器I中SO2的转化率与容器Ⅱ中的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:实验题
侯德榜是我国制碱丁业的先驱,他根据氨碱法制碱的缺点提出用饱和的NaCl溶液、CO2、NH3反应制取纯碱的联合制碱法。某学校课外活动小组根据侯氏制碱法的原理在实验室模拟制碱。请同答下列问题:
(1)写出实验室制取NH3的化学方程式:_______________。
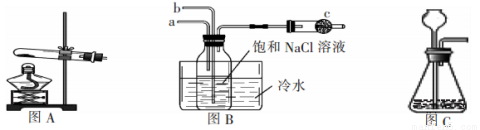
(2)上图B中的a接装置图_________(填图A或图C)
(3)用离子方程式表示装有饱和食盐水的集气瓶中的现象:______________________。
(4)水槽中的冷水的作用除了可以增加气体物质在溶液中的溶解度外还有一个重要作用是:_____________。
(5)图B中c的作用是:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com