
| A. | 1 mol H2O的质量为18g/mol | B. | 3.01×1023个SO2分子的质量为32g | ||
| C. | CH4的摩尔质量为16g | D. | 44g CO2含有的O原子数为NA |
分析 A.质量的单位为g,g/mol为摩尔质量;
B.根据n=$\frac{N}{{N}_{A}}$计算出二氧化硫的物质的量,最高价m=nM计算出水的质量;
C.摩尔质量的单位应该为g/mol;
D.44g二氧化碳的物质的量为1mol,1mol二氧化碳分子中含有2mol氧原子.
解答 解:A.1mol水的质量为:18g/mol×1mol=18g,故A错误;
B.3.01×1023个SO2分子的物质的量为:$\frac{3.01×1{0}^{23}}{6.01×1{0}^{23}mo{l}^{-1}}$=0.5mol,0.5mol二氧化硫的质量为:64g/mol×0.5mol=32g,故B正确;
C.CH4的摩尔质量为16g/mol,故C错误;
D.44g CO2的物质的量为:n(CO2)=$\frac{44g}{44g/mol}$=1mol,1mol CO2分子中含有O的物质的量为2mol,含有氧原子数为2NA,故D错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,注意掌握质量与摩尔质量的区别,试题侧重考查学生的灵活应用能力.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烷 | B. | 丙烯 | C. | 1,3-丁二烯 | D. | 乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H +NO3- Fe 2+Na + | B. | Ag +NO3- Cl -K + | ||
| C. | K +Ba 2+OH -SO42- | D. | Cu 2+NH4+ Br -OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定没有Na2CO3和Ba(NO3)2 | |
| B. | 一定有Na2CO3而没有Ba(NO3)2 | |
| C. | 没有Ba(NO3)2但有KNO3.可能还有Na2CO3 | |
| D. | 没有Na2CO3但有Ba(NO3)2和KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
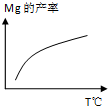 除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com