
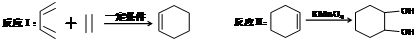
 ,F官能团的名称为醛基,
,F官能团的名称为醛基,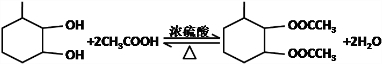 .
. Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色
Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色 的合成路线为
的合成路线为 .
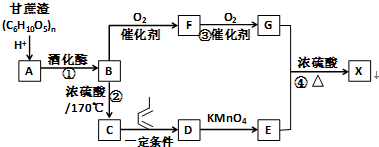
. 分析 甘蔗渣水解得到A为葡萄糖,葡萄糖在酒化酶作用下得到B为CH3CH2OH,乙醇发生氧化反应得到F为CH3CHO,F进一步发生氧化反应得到G为CH3COOH.乙醇发生消去反应得到C为CH2=CH2,乙烯与1,3-戊二烯发生加成反应得到D为 ,D发生氧化反应得到E为
,D发生氧化反应得到E为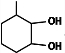 ,E与乙酸发生酯化反应得到X
,E与乙酸发生酯化反应得到X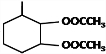 .(6)1,3-丁二烯与乙炔发生加成反应得到1,4-环己二烯,再用高锰酸钾氧化得到目标产物.
.(6)1,3-丁二烯与乙炔发生加成反应得到1,4-环己二烯,再用高锰酸钾氧化得到目标产物.
解答 解:甘蔗渣水解得到A为葡萄糖,葡萄糖在酒化酶作用下得到B为CH3CH2OH,乙醇发生氧化反应得到F为CH3CHO,F进一步发生氧化反应得到G为CH3COOH.乙醇发生消去反应得到C为CH2=CH2,乙烯与1,3-戊二烯发生加成反应得到D为 ,D发生氧化反应得到E为
,D发生氧化反应得到E为 ,E与乙酸发生酯化反应得到X
,E与乙酸发生酯化反应得到X .
.
(1)D的结构简式为 ,F为CH3CHO,官能团的名称为醛基,
,F为CH3CHO,官能团的名称为醛基,
故答案为: ;醛基;
;醛基;
(2)②的反应类型为消去反应,③的反应类型为氧化反应,
故答案为:消去反应;氧化反应;
(3)①的化学方程式为:HOCH2(CHOH)CH2OH$\stackrel{酒化酶}{→}$2CH3CH2OH+2CO2↑,
④的化学方程式为: ,
,
故答案为:HOCH2(CHOH)CH2OH$\stackrel{酒化酶}{→}$2CH3CH2OH+2CO2↑; ;
;
(4)检验甘蔗渣在酸性条件下水解后生成的A为葡萄糖,向用氢氧化钠反应中和酸使溶液呈碱性,再用银氨溶液,在加热条件下有银镜现象产生,说明有葡萄糖生成,
故答案为:NaOH溶液,银氨溶液;
(5)满足下列条件的D( )的同分异构体:Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色,移动碳碳双键位置可以得到其同分异构体,可能的结构简式有:
)的同分异构体:Ⅰ.含六元环Ⅱ.能使溴的四氯化碳溶液褪色,移动碳碳双键位置可以得到其同分异构体,可能的结构简式有: ,
,
故答案为: ;
;
(6)以乙炔、丁二烯为主要有机原料,通过两步反应制备 的合成路线为
的合成路线为 
故答案为: .
.
点评 本题考查有机物的推断与合成,关键是理解题目给予的反应信息,较好的考查学生自学能力、知识迁移运用能力,熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:选择题
| A. | 变小 | B. | 不变 | ||
| C. | 增大 | D. | 可能增大、减小,也可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaHCO3溶液中粒子浓度的关系:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | 0.2 mol/L的HCl和0.1 mol/L的NH3•H2O等体积混合后溶液中的离子浓度关系: c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | pH相同的CH3COONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(NaOH) | |
| D. | 0.1 mol/L的NaHS溶液中粒子浓度关系:c(S2-)+c(OH-)=(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com