
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
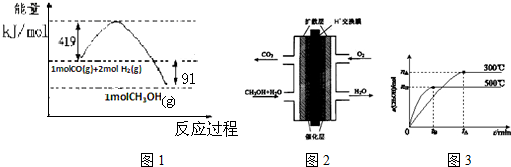
分析 I.(1)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物.
由图1可得热化学方程式:①.CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,
又已知:②.CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
③.H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
根据盖斯定律,③×2+②-①可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(2)△H-T△S<0反应自发进行;
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol
二者相加可得:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,进而计算x的值;
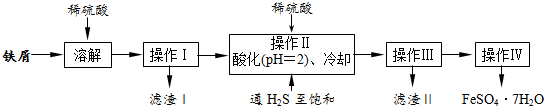
(3)甲醇发生氧化反应,原电池负极发生氧化反应,甲醇在负极通入,氧气在正极通入,由原电池示意图可知,负极是甲醇失去电子生成二氧化碳与氢离子,正极是氧气获得电子,与通过氢离子交换膜的氢离子结合生成水;
Ⅱ.(4)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由图3可知,温度越高平衡时甲醇物质的量越小,说明升高温度平衡逆向移动,平衡常数减小;
(5)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.
解答 解:I.(1)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物.
由图1可得热化学方程式:①.CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,
又已知:②.CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
③.H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
根据盖斯定律,③×2+②-①可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1;
(2)CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol的△H<0、△S<0,△H-T△S<0反应自发进行,故在低温下反应具有自发性;
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol
二者相加可得:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240 kJ/mol,
反应热=反应物总键能-生成物总键能,则436kJ/mol+$\frac{1}{2}$×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,
故答案为:低温;462;
(3)甲醇发生氧化反应,原电池负极发生氧化反应,甲醇在负极通入,氧气在正极通入,由原电池示意图可知,负极是甲醇失去电子生成二氧化碳与氢离子,正极是氧气获得电子,与通过氢离子交换膜的氢离子结合生成水,正极电极反应式为:O2+4e-+4H+=2H2O,
故答案为:负极;O2+4e-+4H+=2H2O;
Ⅱ.(4)CO(g)+2H2(g)?CH3OH(g)化学平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,由图3可知,温度越高平衡时甲醇物质的量越小,说明升高温度平衡逆向移动,平衡常数减小,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;减小;
(5)a.v生成(CH3OH)=v消耗(CO),均表示正反应速率,反应始终按该比例关系进行,故a错误;
b.混合气体总质量不变,容器容积不变,混合气体的密度为定值,故b错误;
c.混合气体总质量不变,随反应进行混合气体物质的量减小,平均相对分子质量增大,但混合气体的平均相对分子质量不再改变,说明反应到达平衡,故c正确;
d.平衡时各组分浓度不变,CO、H2、CH3OH的浓度均不再变化,说明反应到达平衡,故d正确,
故选:cd.
点评 本题考查热化学方程式书写、反应热计算、原电池、化学平衡常数、平衡状态判断,属于拼合型题目,(3)中注意正极电极反应式中产物不能为氢氧根离子,(2)中x计算为易错点,学生容易忽略化学键含义,直接利用氢气燃烧生成液体水的热化学方程式计算.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存在水中 | B. | 密封,保存在广口瓶中 | ||
| C. | 用铝箔包裹,密封在广口瓶中 | D. | 密封,保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 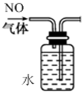 排水法收集NO | |
| B. |  吸收尾气中少量NH3或HCl,并防止倒吸 | |
| C. |  制取并收集少量NH3 | |
| D. | 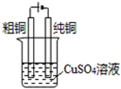 电解精炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁不剩余,Cu剩余 | B. | 铜不剩余、铁剩余 | C. | 铁、铜均剩余 | D. | 铁、铜均不剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
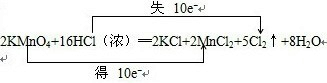 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K | B. | Ba2+、Ca2+、Mg2+ | C. | K+、Ca2+、Cl- | D. | N、O、F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com