
分析 Cu(OH)2从组成上可看成CuO•H2O,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1mol铜,并电解了0.1mol H2O,结合电解方程式计算.
解答 解:Cu(OH)2从组成上可看成CuO•H2O,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1mol铜,并电解了0.1mol H2O,由电解的总反应式:
2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4mol.
故答案为:0.4.
点评 本题考查了电解池原理的应用,为高频考点,题目难度中等,明确阴阳极上离子的放电顺序即可解答,注意把握常见物质的电解方程式,侧重于考查学生的分析能力和对基础知识的应用能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为O2+2H2O+4e-=4OH- | |
| B. | 放电时正极发生氧化反应,外电路中电子从正极流向负极 | |
| C. | 负极反应为CH4+10OH--8e-=CO32-+7H2O | |
| D. | 随着放电的进行,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新的能源 | B. | 合成新的物质 | ||
| C. | 研究物体运动规律 | D. | 防治环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
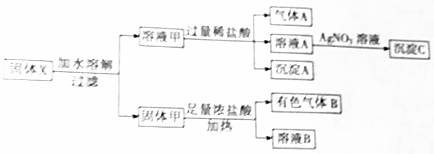
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.
小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑥ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com