
常温下,纯水中存在电离平衡:H2O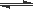 H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
A.H2SO4 B.AlCl3 C.NaHCO3 D.NaOH
科目:高中化学 来源: 题型:
生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO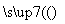 CO2+2H2O+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
A.升高温度 B.增大压强
C.压缩使容器体积变小 D.增大反应物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g) = ZnO(s)△H =-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于
A.-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”“>”“=”);
(2)830°C时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( )
A. H2O2、ZnO B.氨水 C.KMnO4、ZnCO3 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在372K时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为 0.02 mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B. 在2s时体系内压强为开始时的1.1倍
C. 在平衡时体系内含有N2O4 0.25 mol
D. 平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
将20 g M物质、5 g N物质、9 g R物质混合加热发生化学反应,经充分反应后的混合物中含5 g M物质、20 g R物质还含有一种新物质Q,若M、N、R、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是 ( )
A.M+N====R+Q B.M+2N====2R+Q
C.2M+N====2R+Q D.2M+N====R+2Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com