
【题目】雕白块(NaHSO2·HCHO·2H2O,易溶于水,呈白色块状固体或结晶性粉状)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产雕白块及氧化锌的工艺流程如下:
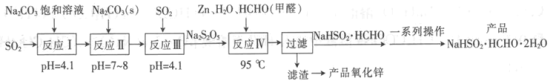
回答下列问题:
(1)NaHSO2·HCHO·2H2O中S元素的化合价为__________。
(2)“反应I”中得到的产物是__________(填化学式)。
(3)设计“反应II”,“反应III”中继续通入SO2的目的是_________。
(4)“反应Ⅳ”的化学方程式为______________。
(5)“过滤”后,“滤渣”是__________(填化学式)。
(6)“一系列操作”包括蒸发浓缩________、________、________干燥。
(7)一种测定雕白块中硫的质量分数的方法如下:称取a g产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为b g。
①雕白块与碘水反应的化学方程式为___________。
②产品中硫的质量分数为___________。
【答案】+2 NaHSO3和CO2 得到NaHSO3过饱和溶液,从而生成Na2S2O5 Na2S2O5+2Zn+2HCHO+3H2O ![]() 2NaHSO2·HCHO+2Zn(OH)2 Zn(OH)2 冷却结晶 过滤 洗涤 NaHSO2·HCHO·2H2O+3I2+H2O=NaHSO4+6HI+HCOOH
2NaHSO2·HCHO+2Zn(OH)2 Zn(OH)2 冷却结晶 过滤 洗涤 NaHSO2·HCHO·2H2O+3I2+H2O=NaHSO4+6HI+HCOOH ![]()
【解析】
SO2和Na2CO3溶液发生反应,最后得到溶液的pH为4.1,溶液显酸性,可知产物为NaHSO3,再加入Na2CO3,再通入SO2,pH为4.1,可以提高溶液中NaHSO3的含量,根据图示最后得到了Na2S2O5。Na2S2O5与Zn、甲醛反应得到目标产物。
(1)根据化合价代数和为0,NaHSO2中Na的化合价+1,H的化合价+1,O的化合价为-2,则S的化合价为+2;
(2)反应Ⅰ,溶液最终的pH为4.1为弱酸性溶液,溶液不可能为Na2SO3,Na2SO3水解呈碱性,应为NaHSO3,根据H2SO3的酸性强于H2CO3,产物还有CO2,则产物为NaHSO3和CO2;
(3)反应Ⅰ通入SO2,反应Ⅱ再加入Na2CO3固体,反应Ⅲ再通入SO2,可以使溶液中NaHSO3的量大大增加,从而形成NaHSO3的过饱和溶液,生成Na2S2O5,答案是得到NaHSO3过饱和溶液,从而生成Na2S2O5;
(4)根据图示,反应物包括Na2S2O5、Zn、HCHO,产物有NaHSO2·HCHO。S的化合价从+4降低到+2,Zn化合价升高得到Zn(OH)2;化学方程式为Na2S2O5+2Zn+2HCHO+3H2O ![]() 2NaHSO2·HCHO+2Zn(OH)2;
2NaHSO2·HCHO+2Zn(OH)2;
(5)根据反应Ⅳ的化学方程式,可知滤渣为Zn(OH)2;
(6)滤液中含有NaHSO2·HCHO,从滤液中得到产品,经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥得到产品;
(7) ①NaHSO2·HCHO·2H2O是还原剂,与I2反应,得到NaHSO4和HCOOH,S的化合价从+2升高到+6,C的化合价从O升高到+2,则1molNaHSO2·HCHO·2H2O共失去6mol电子,I2得到电子,变成I-,根据电子守恒,则NaHSO2·HCHO·2H2O和I2的比例为1:3,再根据原子守恒,可得化学方程式为NaHSO2·HCHO·2H2O+3I2+H2O=NaHSO4+6HI+HCOOH;
②根据硫守恒,NaHSO2·HCHO·2H2O~BaSO4,BaSO4的质量为b,则S的物质的量为![]() ,则S的质量为
,则S的质量为![]() ,质量分数为
,质量分数为![]() 。
。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
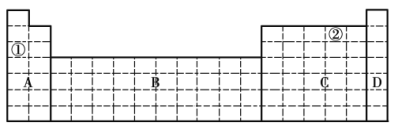
(1)在元素周期表中全部是金属元素的区域为______(填序号)。
a. A b. B c. C d. D
(2)有人认为形成化合物最多的元素不是第IVA族的碳元素,而是另一种短周期元素,请根据学过的化学知识判断这一元素是______(填元素符号)。
(3)①和②元素形成的两种常见化合物的化学式分别为______、______,它们都是______(填“共价化合物”或“离子化合物”)。
(4)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外M层与K层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置______。
②甲、乙两元素中,金属性较强的是______(填元素名称),可以验证该结论的实验有______(填序号)。
a. 将在空气中放置已久的这两种元素的块状单质分别放入热水中
b. 将这两种元素的单质粉末分别和相同浓度的盐酸反应
c. 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d. 比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
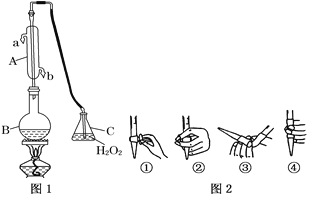
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
A.c(Na+)=c(HSO3-)+2c(SO32-) |
B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
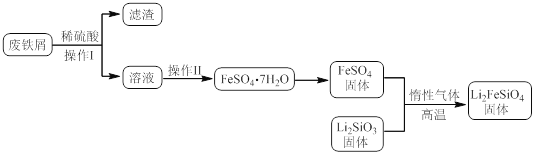
实验(二) Li2FeSiO4含量测定:
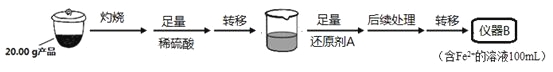
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知
是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知![]() 的一种核素的质量数为18,中子数为10;
的一种核素的质量数为18,中子数为10;![]() 是短周期元素中原子半径最大的元素(不考虑稀有气体元素的原子半径);
是短周期元素中原子半径最大的元素(不考虑稀有气体元素的原子半径);![]() 的单质呈黄色,常见于火山口附近。下列说法正确的是
的单质呈黄色,常见于火山口附近。下列说法正确的是
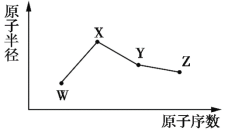
A.![]() 的最高价氧化物对应水化物的酸性强于
的最高价氧化物对应水化物的酸性强于![]()
B.简单离子半径:![]()
C.![]() 的简单氢化物的沸点高于同族其他元素的简单氢化物
的简单氢化物的沸点高于同族其他元素的简单氢化物
D.将标准状况下等体积的![]() 的单质与
的单质与![]() 的低价氧化物同时通入品红溶液中,品红溶液迅速褪色
的低价氧化物同时通入品红溶液中,品红溶液迅速褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法正确的是
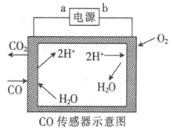
A.b为电源的正极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阳极移动D.理论上每消耗11.2 L O2,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一密闭容器中盛有aL含Cl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是___。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数___。(结果用小数表示,保留3位小数)
②求所得溶液中Cl-与ClO-的物质的量之比___。
③求溶液中ClO-的物质的量___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com