


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制备氧气 | H2O2→O2 | |
| ② | 制备氨气 | NH4Cl→NH3 | |
| ③ | 制备氯气 | HCl→Cl2 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用100ml 4mol/L盐酸与8.7gMnO2共热能制取氯气0.2NA |
| B、一定温度下0.1L 0.1mol/L的HA和1L0.01mol/L的HA所含A-微粒数均为0.01NA |
| C、在常温常压下,44g CO2与N2O的混合物中含有的原子总数为3 NA |
| D、1mol Cl2与足量的金属铝反应,转移电子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
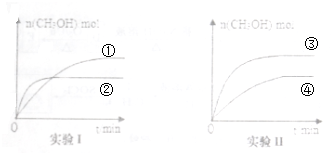
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论 | |
| A | 在相同温度下,向1mL 0.2mol?L-1 NaOH溶液中滴入2滴0.1mol?L-1 CaCl2溶液,产生白色沉淀后,再滴加2滴0.1mol?L-1 FeCl3溶液,又生成红褐色沉淀 | 溶解度:Ca(OH)2>Fe(OH)3 |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体,HA放出的氢气多且反应速率快 | 酸性:HA>HB |
| C | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| D | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com