
| A. | 21g | B. | 18g | C. | 15g | D. | 12g |
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、水煤气、醋酸、干冰 | B. | 液氯、氯水、硫酸钠、乙醇 | ||
| C. | 空气、天然气、苛性钾、硫酸钡 | D. | 胆矾、漂白粉、氯化钾、氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 向该液体中逐滴滴入过量的稀硫酸,会看到液体先生成红褐色沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取3种溶液,滴加紫色石蕊溶液 | 溶液会变红的是①③ | |
| 2 | 用足量的乙酸溶液浸泡碳酸钙 | 有关反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑ | |
| 3 | 将CO2通入苯酚钠溶液中 | 有关反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+NHCO3- | |
| 结论:3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②(填序号) | |||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
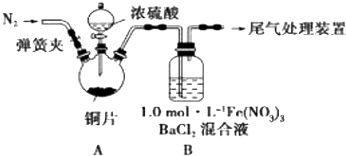
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中含有的阴离子数是0.2NA | |
| B. | 常温常压下,8gO2含有的电子数是4NA | |
| C. | 标准状况下,2.24LCCl4中含有分子数为0.1NA | |
| D. | 1L1.0mol•L-1Na2CO3溶液中含有的氧原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com