

分析 红褐色C为Fe(OH)3,根据元素守恒可知金属A是Fe,Fe在氯气中燃烧生成B为FeCl3,Fe和HCl反应生成FeCl2和H2,FeCl3和Fe反应生成FeCl2,则D为FeCl2,B和NaOH反应生成红褐色的C为Fe(OH)3,D和NaOH溶液反应生成的白色E为Fe(OH)2,Fe(OH)2和氧气、水反应生成Fe(OH)3,再结合题目分析解答.
解答 解:(1)通过以上分析知,A是Fe、B为FeCl3,则B溶液的颜色是黄色,故答案为:Fe; 黄色;
(2)D为FeCl2,即将二价铁转化成三价铁来检验,则方法为:取少量溶液于试管中,先加入KSCN溶液,无明显现象,再加入氯水,溶液变为血红色,证明溶液中有Fe2+,故答案为:取少量溶液于试管中,先加入KSCN溶液,无明显现象,再加入氯水,溶液变为血红色,证明溶液中有Fe2+;
(3)B→D的反应为FeCl3和Fe反应生成FeCl2,离子方程式为2Fe3++Fe=3Fe2+;
E→C的反应为氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:2Fe3++Fe=3Fe2+;4Fe(OH)2+2H2O+O2═4Fe(OH)3.
点评 本题以Fe及其化合物之间的转化为载体考查无机物推断,还涉及离子方程式书写、离子检验等知识点,明确物质性质、基本理论是解本题关键,知道铁离子、亚铁离子的检验方法及实验现象,题目难度不大.


科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列有关仪器的使用正确的是( )
A. 手持试管给试管内的物质加热
B. 用燃着的酒精灯去点燃另一盏酒精灯
C. 用天平称量药品时用手直接拿砝码
D. 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
对于在密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g) 2NH3(g),能说明反应已达到平衡状态的是
2NH3(g),能说明反应已达到平衡状态的是
A.各物质体积分数相等 B.c(NH3)保持不变
C.各物质浓度相等 D.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
在下列各组的比较中,前者比后者大的是
A.同温度、同浓度的NaCl溶液和氨水的导电能力
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
D.25℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
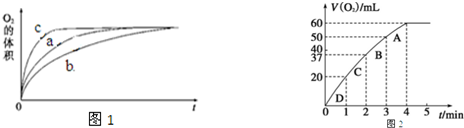
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
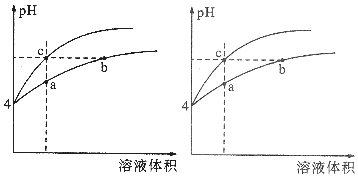 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.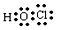 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com