
| A£® | µē³Ų·Åµē¹ż³ĢÖŠ£¬Õż¼«µē¼«·“Ó¦Ź½ĪŖ£ŗNiOOH+H2O+e-ØTNi£ØOH£©2+OH- | |
| B£® | ³äµē¹ż³ĢÖŠŅõ¼«µÄµē¼«·“Ó¦Ź½£ŗH2O+M+e-ØTMH+OH-£¬H2OÖŠµÄH±»M»¹Ō | |
| C£® | ³äµē¹ż³ĢÖŠOH-Ąė×Ó“ÓŃō¼«ĻņŅõ¼«ĒØŅĘ | |
| D£® | NiMHµē³ŲÖŠæÉŅŌÓĆKOHČÜŅŗ”¢°±Ė®µČ×÷ĪŖµē½āÖŹČÜŅŗ |
·ÖĪö ÄųĒāµē³ŲÖŠÖ÷ŅŖĪŖKOH×÷µē½āŅŗ³äµēŹ±£¬Ńō¼«·“Ó¦£ŗNi£ØOH£©2+OH--e-=NiOOH+H2O”¢Ņõ¼«·“Ó¦£ŗM+H2O+e-=MH+OH-£¬×Ü·“Ó¦£ŗM+Ni£ØOH£©2=MH+NiOOH£»
·ÅµēŹ±£¬Õż¼«£ŗNiOOH+H2O+e-=Ni£ØOH£©2+OH-£¬øŗ¼«£ŗMH+OH--e-=M+H2O£¬×Ü·“Ó¦£ŗMH+NiOOH=M+Ni£ØOH£©2£¬ŅŌÉĻŹ½ÖŠMĪŖ“¢ĒāŗĻ½š£¬MHĪŖĪüø½ĮĖĒāŌ×ӵē¢ĒāŗĻ½š£¬
A£®Õż¼«·¢Éś»¹Ō·“Ó¦£»
B£®H2OÖŠµÄHµĆµē×Ó£¬²»ŹĒ±»M»¹Ō£»
C£®µē½āŹ±ŅõĄė×ÓĻņŃō¼«ŅĘ¶Æ£»
D£®Ņņ·¢Éś6NiOOH+NH3+H2O+OH-=6Ni£ØOH£©2+NO2-£¬²»ÄÜÓĆ°±Ė®×öµē½āÖŹČÜŅŗ£®
½ā“š ½ā£ŗÄųĒāµē³ŲÖŠÖ÷ŅŖĪŖKOH×÷µē½āŅŗ ³äµēŹ±£¬Ńō¼«·“Ó¦£ŗNi£ØOH£©2+OH-=NiOOH+H2O+e-”¢Ņõ¼«·“Ó¦£ŗM+H2O+e-=MH+OH-£¬×Ü·“Ó¦£ŗM+Ni£ØOH£©2=MH+NiOOH£»
·ÅµēŹ±£¬Õż¼«£ŗNiOOH+H2O+e-=Ni£ØOH£©2+OH-£¬øŗ¼«£ŗMH+OH-=M+H2O+e-£¬×Ü·“Ó¦£ŗMH+NiOOH=M+Ni£ØOH£©2£¬ŅŌÉĻŹ½ÖŠMĪŖ“¢ĒāŗĻ½š£¬MHĪŖĪüø½ĮĖĒāŌ×ӵē¢ĒāŗĻ½š£¬
A£®Õż¼«·¢Éś»¹Ō·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗNiOOH+H2O+e-ØTNi£ØOH£©2+OH-£¬¹ŹAÕżČ·£»
B£®H2OÖŠµÄHµĆµē×Ó£¬²»ŹĒ±»M»¹Ō£¬¹ŹB“ķĪó£»
C£®µē½āŹ±ŅõĄė×ÓĻņŃō¼«ŅĘ¶Æ£¬Ńō¼«·“Ó¦£ŗNi£ØOH£©2+OH-=NiOOH+H2O+e-£¬ĖłŅŌOH-Ąė×Ó“ÓŅõ¼«ĻņŃō¼«£¬¹ŹC“ķĪó£»
D£®Ņņ·¢Éś6NiOOH+NH3+H2O+OH-=6Ni£ØOH£©2+NO2-£¬²»ÄÜÓĆ°±Ė®×öµē½āÖŹČÜŅŗ£¬¹ŹD“ķĪó£®
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²éĮĖŌµē³ŲŗĶµē½ā³ŲŌĄķ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦µÄ漲飬Ć÷Č·ĢāøųŠÅĻ¢µÄŗ¬ŅåŹĒ½ā±¾Ģā¹Ų¼ü£¬ÄѵćµÄµē¼«·“Ó¦Ź½µÄŹéŠ“£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Įņ»ÆÄĘŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®¹¤ŅµÉĻÓĆĮņĖįÄĘÓėĢ¼·“Ó¦µĆµ½Įņ»ÆÄĘ£®·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ
Įņ»ÆÄĘŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®¹¤ŅµÉĻÓĆĮņĖįÄĘÓėĢ¼·“Ó¦µĆµ½Įņ»ÆÄĘ£®·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 H2S£ŗ
H2S£ŗ Na2O2£ŗ
Na2O2£ŗ £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | KNO3ČÜŅŗ | B£® | FeCl3ČÜŅŗ | C£® | Al2£ØSO4£©3ČÜŅŗ | D£® | FeSO4ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ClO3-£¾BrO3-£¾Cl2£¾Fe3+£¾I2 | B£® | BrO3-£¾Cl 2£¾ClO3-£¾I2£¾Fe3+ | ||
| C£® | BrO3-£¾ClO3-£¾Cl2£¾Fe3+£¾I2 | D£® | BrO3-£¾ClO3-£¾Fe3+£¾Cl2£¾I2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹŌ¹Ü”¢Õō·¢Ćó | B£® | ŹŌ¹Ü”¢ÉÕ± | C£® | ŹŌ¹Ü”¢Ę½µ×ÉÕĘæ | D£® | Õō·¢Ćó”¢Ō²µ×ÉÕĘæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
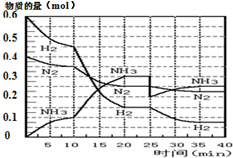 °±µÄŗĻ³ÉŌĄķĪŖ£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£»”÷H=-92.4KJ•mol-1£®ĻÖŌŚ500”ę”¢20MPaŹ±£¬½«N2”¢H2ÖĆÓŚŅ»øöČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬·“Ó¦¹ż³ĢÖŠø÷ĪļÖŹµÄĪļÖŹµÄĮæ±ä»ÆČēĶ¼£®
°±µÄŗĻ³ÉŌĄķĪŖ£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£»”÷H=-92.4KJ•mol-1£®ĻÖŌŚ500”ę”¢20MPaŹ±£¬½«N2”¢H2ÖĆÓŚŅ»øöČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬·“Ó¦¹ż³ĢÖŠø÷ĪļÖŹµÄĪļÖŹµÄĮæ±ä»ÆČēĶ¼£®| T/K | 303 | 313 | 323 |
| NH3Éś³ÉĮæ/£Ø10-6mol£© | 4.8 | 5.9 | 6.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ņ»øöøĆĘųĢå·Ö×ÓµÄÖŹĮæĪŖM/NA | |
| B£® | Ņ»øöøĆĘųĢå·Ö×ÓµÄĢå»żĪŖVm/NA | |
| C£® | ĘųĢåĦ¶ūĢå»żµÄ“óŠ”Č”¾öÓŚĘųĢå·Ö×Ó±¾ÉķµÄ“óŠ” | |
| D£® | ÉĻŹöĖµ·Ø¾ł²»ÕżČ· |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com