
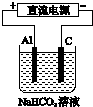
 某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.
某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.分析 (1)充电时阴极上得电子发生还原反应;
(2)根据氢氧化亚铁和转移电子之间的关系式计算;
(3)阳极上铝失电子生成铝离子,铝离子和碳酸氢根离子发生双水解反应;
(4)精炼粗铜时,粗铜作阳极、纯铜作阴极,据此回答.
解答 解:(1)充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,故答案为:Fe(OH)2;
(2)转移电子物质的量=$\frac{18g}{90g/mol}$(2-0)=0.4mol,
故答案为:0.4;
(3)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al=Al3++3e-、Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)精炼粗铜时,粗铜作阳极、纯铜作阴极,所以粗铜与电源正极相连,阴极发生得电子的还原反应,发生反应的电极反应式为:Cu2++2e=Cu;
故答案为:正;Cu2++2e=Cu.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,难点是铝离子和碳酸氢根离子发生双水解的反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
你认为下列行为中 有悖于“节能减排,和谐发展”这一主题的是( )
有悖于“节能减排,和谐发展”这一主题的是( )
A.将煤进行气化处理,提高煤的综合利用效率
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用观,即:减少资源消耗、增加资源的重复使用、资源的循环再生
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
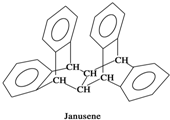 如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )| A. | Janusene的分子式为C30H20 | |
| B. | Janusene属于苯的同系物 | |
| C. | Janusene苯环上的一氯代物有8种 | |
| D. | Janusene既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4L氩气含有原子数为2Na | |
| C. | 常温常压下,32g O2和O3混合气所含氧原子数是2NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com