
某研究小组甲欲用KMnO4测定FeSO4的含量。
(1)①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液200 mL,配制时需要的仪器除天平、药匙外,还需要的仪器有_____、_____、_____、_____、_____。
②用KMnO4(酸化)滴定时,含硫酸亚铁的溶液放在_____(填仪器)中,高锰酸钾溶液放在______(填仪器)中,滴定终点时溶液的颜色为_____色。
(2)另一研究小组乙设计了如下测量方案: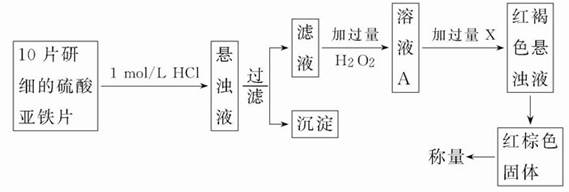
①过滤时用到的玻璃仪器有________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有_____(按操作的顺序填写)。
A过滤;B洗涤;C萃取;D分液;E冷却;F灼烧
科目:高中化学 来源: 题型:填空题
某化学小组的同学到实验室学习。在实验桌上摆有如图所示仪器:
(1)指导教师要求同学们写出仪器的名称,某同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则此空不需要填写)。
| 仪器编号 | a | b | c | d | e |
| 名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
| 改正的名称 | | | | | |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。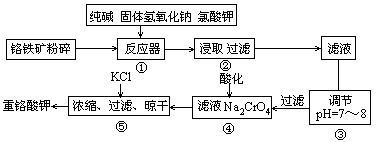
(1)碱浸前将铭铁矿粉碎的作用是
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
;
(4)用简要的文字说明操作⑤加入KCl的原因 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分) (1)某兴趣小组欲准确配制一定物质的量浓度的NaOH溶液:快速准确称取8.0 g 纯净的NaOH固体,配制成100 mL溶液,该NaOH溶液的物质的量浓度为 。所需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少 。
(2)有机物X由C、H、O三种元素组成的,为确定其结构进行如下实验:
a.6.0 g X在一定条件下完全分解,生成3.36 L(标准状况下)一氧化碳和1.8 g水;
b.中和2.4 g 有机物X需消耗上述NaOH溶液20.00 mL;
c.0.1 mol有机物X完全转化为酯,需要乙醇9.2 g,0.1 mol X能与足量钠反应放出3.36 L(标准状况下)氢气。则:
①X的相对分子质量为 。
②X的分子式为 。
③写出X的结构简式: 。
④写X与足量乙醇发生酯化反应的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(18分)硫代硫酸钠在工业生产中用途非常广泛。
(1)Na2S2O3溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2)Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
①装置B的作用是检验装置A中SO2的吸收效率,则B中试剂是________________,表明SO2吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的Na2CO3含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学用下列装置(固定、加热仪器和橡胶管已经省略)进行有关气体制取及其相关实验的探究,回答下列问题.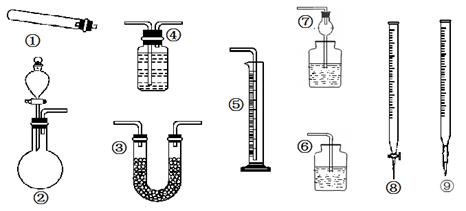
(1)若用装置①制取NH3,其反应的化学方程式为 ;多余的氨气应选用 装置吸收。(填装置序号,下同)
(2)若用装置②制乙炔,其反应的化学方程式为 ;要测定生成乙炔的体积,则必须选择的装置是 ,因制取的乙炔常含有杂质,若要除去杂质,所选装置中应盛放的试剂为: 。
(3)若用装置②制取乙烯,少了一种重要仪器 _。
(4)若用0.01mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸溶液,酸性高锰酸钾溶液应装在装置 中。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)某学生欲用11.9 mol·L-1的浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。该学生需要量取________mL浓盐酸进行配制。(保留小数点后1位)
(2)容量瓶是配制溶液的必需仪器。下列关于容量瓶及其使用方法的叙述,错误的是
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶长期贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液
⑥容量瓶上标有的是温度 、容量 、刻度线
a.① ③ b.① ④ c.③ ⑤ d.⑤ ⑥
(3)① 该同学用配制的0.400 mol·L-1的盐酸,中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
② 假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
a.浓盐酸挥发,浓度不足
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制备苯乙酮的化学方程式为:
制备过程中还有CH3COOH+AlCl3―→CH3COOAlCl2+HCl↑等副反应。
主要实验装置和步骤如下:
(Ⅰ)合成:在三颈瓶中加入20g无水三氯化铝和30mL
无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6mL
乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液
缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层②水层用苯萃取,分液③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品④蒸馏粗产品得到苯乙酮
回答下列问题:(1)仪器a的名称:________;装置b的作用:________。
(2)合成过程中要求无水操作,理由是_______________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1MgSO4溶液和0.5mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL四口烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是 。
②步骤3生成MgCO3·nH2O沉淀的离子方程式为 。
③步骤4检验是否洗涤干净的方法是 。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
(3)称取100g上述晶须产品进行热重分析,热重曲线如图。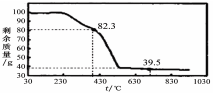
则该条件下合成的晶须中,n= (选填:1、2、3、4、5)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com