
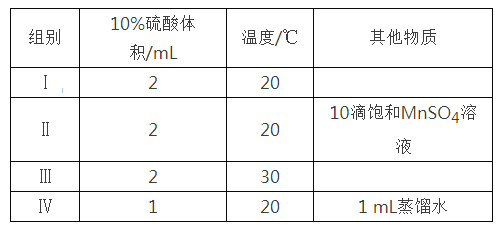
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4—+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
(1)写出该反应的离子方程式______________________,该反应中每生成1molCO2 转移电子数为________ 。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和________(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验________和_________。
(3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是______________________。
【答案】2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O NA Ⅰ Ⅱ Ⅰ Ⅲ 硫酸的浓度或氢离子浓度 确保溶液总体积不变
【解析】
(1)氧化还原反应可根据得失电子守恒进行配平;
(2)探究反应物浓度、温度、催化剂对反应速率影响,需在其它条件相同的条件下设置对比实验;
(3)对比实验I和IV,根据两个实验中硫酸的量不同分析实验目的;对比实验中,必须确保溶液总体积相同。
(1)反应中MnO4—中Mn由+7价降为+2价,得到电子,发生还原反应,H2C2O4中C由+3价升为+4价,失去电子,发生氧化反应,根据氧化还原反应中得失电子守恒可知,MnO4—与H2C2O4化学计量数之比为2:5,再根据原子守恒和电荷守恒配平方程式,2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,因此该反应中每生成1molCO2 转移电子数为1mol电子,即NA个电子。
(2)由实验目的可以知道,探究反应物浓度、温度、催化剂对反应速率影响,需在相同的条件下对比实验;同浓度溶液,在相同温度下进行反应,Ⅰ无催化剂,,Ⅱ有催化剂,Ⅰ、Ⅱ是研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,则除了温度不同外,其它条件必须完全相同,所以Ⅰ和Ⅲ是探究温度对反应速率的影响;
(3)对比实验I和IV,10%硫酸的体积不同,说明两组实验中的反应物的浓度不同,所以探究的是反应物硫酸(或氢离子)的浓度对化学反应速率的影响;
对比实验I和IV,IV中只加入1mL10%硫酸,与I中加入的溶液总体积不相等,实验IV中需要加入1mL蒸馏水,确保反应溶液的总体积相同。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是___________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品

①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(______)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
(4)设计实验检验环己烯精品中是否含己二醛_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际单位制中的7个基本物理量之一
B.硫酸的摩尔质量是98 g
C.0.5molH2 约含有3.01×1023 个氢原子
D.NA个氧气分子的质量是32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________
(2)该氢氧化钠溶液浓度为______________
(3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO2CrH2O)]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在密闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是______;仪器b的名称是______。
(2)连通管a的作用是______;装置丙的作用是______。
(3)将过量锌粒和氯化铬固体置于b中,加入少量蒸馏水,按图连接好装置。打开K1、K3,关闭K2。
①b中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为______;
②同时b中有气体产生,该气体的作用是______。
(4)欲使b中亮蓝色溶液流入乙,在乙中析出砖红色沉淀,接下来的操作为打开______,关闭K3和______。其原因是______。
(5)该实验中盐酸必须适量,不能过量的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行的反应:N2+3H22NH3(正反应为放热反应),下列说法正确的是
A. 降低温度能加快逆反应速率
B. 保持体积不变,充入N2,能加快反应速率
C. 达到平衡时,反应速率:v(正)=v(逆)=0
D. 达到平衡时,N2和H2能100%转化为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


(1)酸浸后加入H2O2的目的是______,调pH的最适宜范围为______。
(2)调pH过程中加入的试剂最好是_________。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
(3)煮沸CuSO4溶液的原因是______。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式________________。
(4)称取所制备的CuCl样品0.2500g置于一定量的FeCl3溶液中,待样品完全溶解后加水20 mL,用0.1000mol﹒L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数_______________。
(5)在一定条件下用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com