

分析 (1)缓缓通入空气数分钟,将装置中生成的CO2全部排入C装置中,以免影响测量结果;
(2)①B装置中的浓硫酸能干燥二氧化碳;
②D装置中的氢氧化钠能吸收空气中的二氧化碳;
(3)①C装置直接与空气相通,会吸收空气中CO2和水蒸气;
②在C的后面连接一个能吸收CO2和水蒸气的装置;
(4)测得反应前C仪器和药品的质量为bg,反应后C仪器和药品的质量为cg,则二氧化碳的质量为(c-b)g,根据方程式计算碳酸钠的质量,再计算碳酸钠的质量分数;
(5)碳酸钙的式量小于碳酸钡,称量时误差较大.
解答 解:(1)反应停止后缓缓鼓入空气数分钟,将装置中生成的CO2全部排入C装置中,使二氧化碳全部被碱石灰吸收,以免影响测量结果,
故答案为:将装置中生成的CO2全部排入C装置中;
(2)①B装置中的浓硫酸能干燥二氧化碳,可以防止了水蒸气进入C装置,从而对测定的结果产生影响;
故答案为:在A、C中加入B装置,防止了水蒸气对测定的影响;
②D装置中的氢氧化钠能吸收空气中的二氧化碳,向装置中鼓入空气时,能够排除空气中二氧化碳的干扰;
故答案为:D装置防止了通入空气时引入CO2的干扰;
(3)①C装置直接与空气相通,会吸收空气中CO2和水蒸气,使C装置的质量偏大,产生误差;
故答案为:C装置中的碱石灰会吸收空气中CO2和水蒸气,从而影响测定结果;
②在C的后面连接一个能吸收CO2和水蒸气的装置,所以在C装置之后再连接一个盛有碱石灰的干燥管,可以防止空气中CO2和水蒸气进入C中;
故答案为:在C装置之后再连接一个盛有碱石灰的干燥管;
(4)测得反应前C仪器和药品的质量为bg,反应后C仪器和药品的质量为cg,则二氧化碳的质量为(c-b)g,
Na2CO3~~~~CO2
106 44;
mg (c-b)g
解得m=$\frac{106(c-b)}{44}$=$\frac{53(c-b)}{22}$g,则ω(Na2CO3)═$\frac{53(c-b)}{22a}$;
故答案为:$\frac{53(c-b)}{22a}$;
(5)丙和丁同学都提出了用沉淀法测定CO32-的方案,两种实验方法相同,但是碳酸钙的式量小于碳酸钡,相同物质的量两种物质,碳酸钡的质量较大,称量时误差较小,所以丙方案劣于丁方案;
故答案为:劣于.
点评 本题考查了物质含量测定方法的综合应用,题目涉及装置作用的分析判断、实验方案设计与评价等,掌握实验基本操作是解题关键,题目难度中等.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
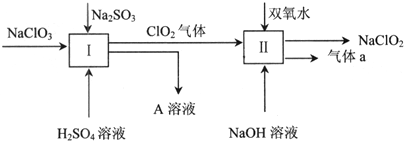
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取ag混合物充分加热,剩余bg固体 | |
| B. | 取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg | |
| C. | 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 | |
| D. | 取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | P的平均反应速率是0.15mol/(L•min) | B. | Q的转化率是25% | ||
| C. | Q的平衡浓度是1mol/L | D. | x的值为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
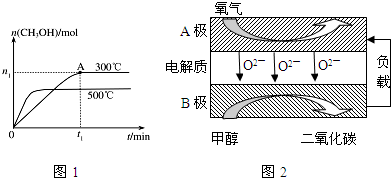
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氯甲烷(CH3Cl) | B. | 甲基(-CH3 ) | C. | 碳负离子(CH3-) | D. | 乙烯(C2H4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com