
【题目】下列说法正确的是( )
A.加热杀死流感H7N9病毒是因为蛋白质受热发生盐析
B.医用酒精灭活新冠肺炎病毒是利用其氧化性
C.我国研制的重组新冠疫苗无需冷藏保存
D.乙烯的产量通常用来衡量一个国家石油化工的水平
科目:高中化学 来源: 题型:
【题目】(题文)掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO2和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SeO3(aq) △H2
H2SeO4(aq)+3SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
则△H2=_____________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为____________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示,
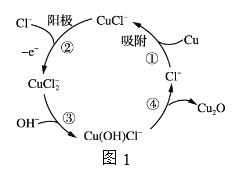
①阳极的电极反应式为_________________________。
②电解一段时间后,向电解液中补充一定量的_________________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按![]() =1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
=1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
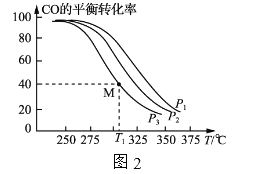
①a_____(填“>”或“<”)0;压强p1、p2、p3由小到大的顺序是___________________。
②T1℃时若向该容器中充入2.0molH2和2.0molCO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=____mol·L-1·min-1,M点对应条件下反应的平衡常数
为________________。
(5)将CuCl水解再热分解可得到纳米Cu2O。CuCl水解的反应为CuC(s) +H2O(l) ![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)积极保护生态环境可实现人与自然的和谐共处。
①下列做法会加剧温室效应的是__________(填字母)。
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是_____________(填字母)。
a.使用可降解塑料 b.露天焚烧废旧塑料 c.直接填埋废旧塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹。“禁止燃放烟花爆竹”的标识是_____(填字母)。

(2)合理使用化学知识可提高人们的生活质量。
某品牌牙膏的成分有甘油、山梨酸钾、氟化钠等。
①在上述牙膏成分中,属于防腐剂的是_______________。
②甘油的结构简式为____________;油脂水解可生成甘油和_____________。
③氟化钠(NaF)可与牙齿中的羟基磷酸钙[Ca5(PO4)3OH]反应,生成更难溶的氟磷酸钙[Ca5(PO4)3F],从而达到防治龋齿的目的。写出该反应的化学方程式:____________________。
(3)创新发展材料技术科推动人类社会的进步。
①石墨烯(见下图)可用作太阳能电池的电极,这里主要利用了石墨烯的______________性。

②基础工程建设中常用到水泥、玻璃、钢材等。生成水泥和玻璃都用到的原料是__________;在钢材中添加铬、镍等元素的目的是___________。
③新型战斗机常用纳米SiC粉体作为吸波材料。高温下焦炭和石英反应可制得SiC,石英的化学式为________________;高温分解Si(CH3)2Cl2也可制得SiC,同时还生成CH4和一种常见酸性气体,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
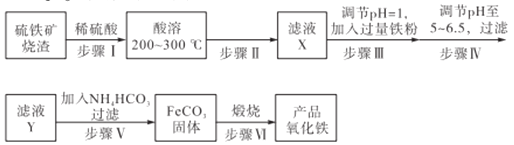
试回答下列问题:
(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;该步骤是为了除去_______(填相关物质的化学式)。
(2)检验步骤III已经进行完全的操作是_______________________。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是______________;该步骤中反应生成FeCO3的离子反应方程式为___________。
(4)步骤VI中发生反应的化学反应方程式为____________________。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤_____(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离的方法正确的是( )
A.从碘水中提取碘:用酒精萃取
B.除去CO中少量O2:通过灼热的Cu网后收集气体
C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D.除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
B | 向②中滴入NaHCO3溶液 | 有白色沉淀生成 | 原溶液中有AlO2- |
C | 向③中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
D | 向④中滴加氯水和CCl4,振荡静置 | 下层溶液呈橙色 | 原溶液中有I- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 氨水 | 食盐水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化铁 | 家用食醋 | 硫酸钡 | 碳酸 | 蔗糖 |
C | 胆矾 | 碘酒 | 苛性钠 | 碳酸 | 碳酸钙 |
D | 盐酸 | 氯化钾溶液 | 氯化钠 | 氢氧化铜 | 氢气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NO2和N2O4可以相互转化N2O4 (g)![]() 2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(x)/mol·L-1 | 0.2 | C | 0.6 | 0.6 | 1.2 | C1 | C1 |
c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | C2 | C2 |
①前10 min内用N2O4表示的化学反应速率v(N2O4)=__________,t℃时,该反应的化学平衡常数K=__________。
②20min时,若只改变了某一个条件,该条件可能是__________。
③t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
(2)一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应S2Cl2(g) + Cl2(g)![]() 2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
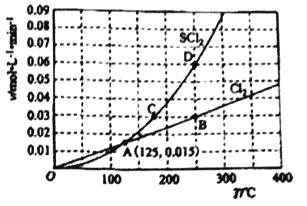
①ABCD四点对应状态下,达到平衡状态的有__________。
②△H2_______0(填“>”“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com