
可用如图所示装置制取、净化、收集的气体是
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
科目:高中化学 来源: 题型:填空题
纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景。下图是利用海水制盐的副产品制备纳米氧化镁的流程图。
(1)操作I包括蒸发结晶、____________。
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol·L-1,要使镁离子产生沉淀,溶液的pH最低应为_____________。(已知:Ksp[Mg(OH)2]= 1.8×10-11)
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3·H2O,还发生另一主要化学反应的离子方程式为______________________________。
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响。请完成以下实验设计表:
| 实验 编号 | T/K | 反应 时间/h | 反应物的物质的量配比 n[CO(NH2)2]∶n[MgCl2?6H2O] | 实验目的 |
| ① | 378 | 3 | 3∶1 | (I)实验①和③探究探究反应物的物质的量配比对产率的影响; (II)实验②和④探究 ; (III)实验②和 探究反应时间对产 率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | | |
| ④ | 398 | 4 | 4∶1 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3 +14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
⑤制备过程中可能用到的部分装置如下:

请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为 。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
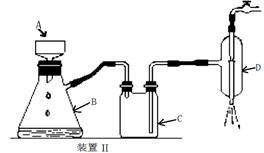
(4)操作A的名称为 ,进行该操作的装置是 (填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是 。
装置Ⅱ中仪器A、B、C、D的名称分别是 、 、 、 。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些? 。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
如图甲是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。
甲
(1)实验时应先点燃_____________(填“A”或“B”)处的酒精灯。
(2)硬质玻璃管中反应的化学方程式为__________________________________。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图乙是他设计的贮气瓶,尾气应从__________(填“a”或“b”)口通入(其他装置略)。
乙
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要?____________,理由是________________。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: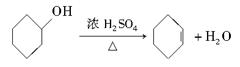
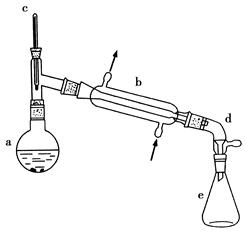
可能用到的有关数据如下:
| | 相对分子质量 | 密度 g/cm3 | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和 。
(2)据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是 。
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。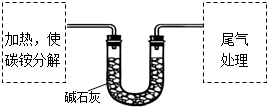
(1)碳铵固体应放在 中进行加热。
| A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
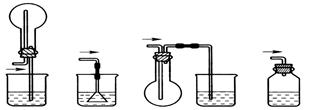
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com