

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| 一定条件 |







查看答案和解析>>
科目:高中化学 来源: 题型:
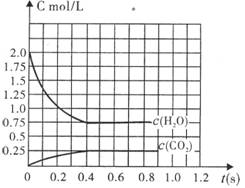 在完全满足可逆反应:2H2O(g)
在完全满足可逆反应:2H2O(g) ![]() 2H2+O2,2CO+O2
2H2+O2,2CO+O2 ![]() 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入l L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入l L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
(1)请在图中画出c(H2)随时间t的变化曲线图;
(2)平衡时c(O2)平为 mol/L。
(3)欲计算出平衡时O2的浓度,除已知“H2O(g)
和CO”的物质的量外,至少需要知道平衡体
系中某两种气体的平衡浓度。这两种气体除
可以是H2O和CO2外还可以是 。
(4)在其它条件不变的情况下,若改为起始时在
 容器中充入2molH2和2molCO2,则上述两反
容器中充入2molH2和2molCO2,则上述两反
应达到平衡时,c(O2)平= mol/L。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三第三次模拟考试(理综)化学部分 题型:填空题
(15分)
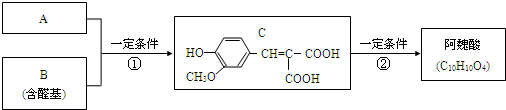
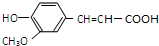
已知:
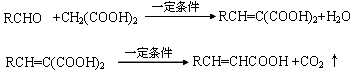
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)

A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体。
(1)A的结构简式是________________。
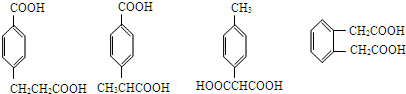
(2)在中学学过知识里 B不可能发生的反应是________ (填序号)
a、取代反应 b、加成反应c、氧化反应d、 还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是________________
(4)写出C与足量的Na2CO3的化学方程式为:__________________________________
(5)写出符合下列条件的阿魏酸所有的同分异构体的结构简式: __
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2气体;
④该同分异构体进行核磁共振氢谱分析发现只有4种峰。
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com