
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
分析 A.KSP只于温度有关;
B.银离子与氨水生成氢氧化二氨合银;
C.Qc>Ksp时生成沉淀,Qc与KSP差别越大,越容易生成沉淀;
D.沉淀转化为溶解度更小的物质容易发生.
解答 解:A.KSP只于温度有关,与溶液中离子浓度无关,则AgCl在饱和NaCl溶液中的Ksp与在纯水中的Ksp相同,故A错误;
B.银离子与氨水生成氢氧化二氨合银,使AgCl的溶解平衡向右移动,故B正确;
C.在AgCl饱和溶液中,Qc(AgCl)=c(Ag+)•c(Cl-)=0.001mol•L-1×0.001mol•L-1=1×10-6mol2•L-2>1.8×10-10mol2•L-2,在Ag2CrO4饱和溶液中,Qc(Ag2CrO4)=c(Ag+)2•c(CrO42-)=0.001mol•L-1×0.001mol•L-1×0.001mol•L-1=1×10-9mol3•L-3>1.9×10-12mol3•L-3,所以均会产生沉淀,故C错误;
D.沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)>KSP(AgBr),故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于考查学生的分析能力的考查,题目难度不大,注意沉淀转化为溶解度更小的物质容易发生.


科目:高中化学 来源: 题型:解答题
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
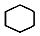 $→_{①}^{Cl_{2},光照}$
$→_{①}^{Cl_{2},光照}$ $→_{②}^{NaOH,乙醇,△}$A$→_{③}^{溴水}$B$\stackrel{④}{→}$
$→_{②}^{NaOH,乙醇,△}$A$→_{③}^{溴水}$B$\stackrel{④}{→}$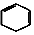 $→_{⑤}^{Br_{2},催化剂}$
$→_{⑤}^{Br_{2},催化剂}$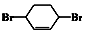 $\stackrel{⑥}{→}$
$\stackrel{⑥}{→}$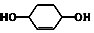
 ,B的结构简式是
,B的结构简式是 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca2+、Al3+、HCO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | Na+、NH4+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com