
分析 此时容器内压强比反应前减少20%,可知物质的量减少20%,假设达到平衡时消耗2molSO2,则
2SO2+O2?2SO3
起始(mol) 4 2 0
转化(mol) x 0.5x x
平衡(mol) 4-x 2-0.5x x
结合容器内压强比反应前减少20%计算该题.
解答 解:此时容器内压强比反应前减少20%,可知物质的量减少20%,假设达到平衡时消耗2molSO2,则
2SO2+O2?2SO3
起始(mol) 4 2 0
转化(mol) x 0.5x x
平衡(mol) 4-x 2-0.5x x
则(4+2)×(1-20%)=(4-x+2-0.5x+x),
x=2.4,
则转化率为$\frac{2.4}{6}×100%$=60%,
故答案为:60%.
点评 本题考查化学平衡的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,本题可用三段式法,也可用差量法计算参加反应的SO2的物质的量,生成的SO3的物质的量,简化计算,注意优化解题方法.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
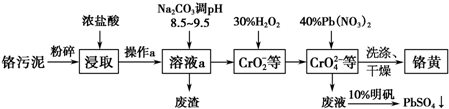
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯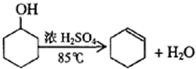
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
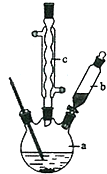 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: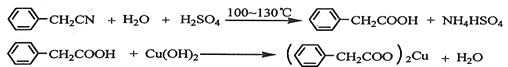
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com