

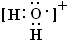 ,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+. 分析 周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)Cl位于第三周期第ⅤⅡA族;
(2)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(3)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(4)由题目信息可知,①4Al(s)+3O2(g)═2Al2O3(s)△H=-4akJ/mol,②C(s)+O2(g)═CO2(g)△H=-bkJ/mol,一定条件下,A的单质能将B从它的最高价氧化物中置换出来,发生反应:4Al+3CO2$\frac{\underline{\;一定条件\;}}{\;}$2Al2O3+3C,根据盖斯定律计算该反应的反应热;
(5)用铝和石墨作电极,硝酸稀溶液作电解质溶液构成原电池,发生铝和硝酸之间的氧化还原反应,正极发生的是得电子的还原反应,硝酸根在正极放电生成NO与水;
(6)F与D同主族且相邻,则F为S元素,非金属性O>S,利用单质之间的置换反应比较;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水.
解答 解:周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)Cl的质子数为17,原子结构有3个电子层,最外层电子数为7,则位于第三周期第ⅤⅡA族,故答案为:第三周期第ⅤⅡA族;
(2)N3-、O2-、Al3+具有的核外电子排布,核电荷数越大,离子半径越小,则离子半径N3->O2->Al3+,故答案为:N3->O2->Al3+;
(3)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,发生氧化还原反应生成氯气、水、KCl,反应方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O;
(4)在298K下,Al、C的单质各1mol完全燃烧,分别放出热量a kJ和b kJ,则热化学方程式为:
①4Al(s)+3O2(g)═2Al2O3(s)△H=-4aKJ/mol
②C(s)+O2(g)═CO2(g)△H=-bKJ/mol
铝单质将碳从CO2中置换出来生成3molC的单质的方程式为:4Al+3CO2$\frac{\underline{\;一定条件\;}}{\;}$2Al2O3+3C,
由盖斯定律可知,①-②×3可得:4Al(s)+3CO2(g)=2Al2O3(s)+3C(s),则△H=-4akJ/mol-(-bkJ/mol)×3=-(4a-3b)kJ/mol,
故答案为:-(4a-3b)kJ/mol;
(5)用铝和石墨作电极,硝酸稀溶液作电解质溶液构成原电池,发生铝和硝酸之间的氧化还原反应,正极发生的是得电子的还原反应,硝酸根在正极放电生成NO与水,正极电极反应式为NO3-+3e-+4H+=NO↑+2H2O,
故答案为:NO3-+3e-+4H+=NO↑+2H2O;
(6)F与D同主族且相邻,则F为S元素,非金属性O>S,利用单质之间的置换反应可说明,实验为向硫化氢溶液中通入氧气,有淡黄色沉淀生成,
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为: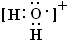 ,该离子含极性共价键,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为2H2O++H2S=S↓+2H2O+2H+,
,该离子含极性共价键,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为2H2O++H2S=S↓+2H2O+2H+,
故答案为:向硫化氢溶液中通入氧气,有淡黄色沉淀生成;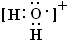 ;极性共价键;2H2O++H2S=S↓+2H2O+2H+.
;极性共价键;2H2O++H2S=S↓+2H2O+2H+.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物及周期律等为解答的关键,侧重分析与应用能力的考查,注意反应原理的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 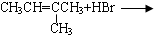 | B. | CH3CH2OH+O2$→_{△}^{Cu}$ | ||
| C. | CH4+Cl2 $\stackrel{光照}{→}$ | D. | nCH2=CH2$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TNT | B. | 白磷的CS2溶液 | C. | 黑火药和甘油 | D. | KMnO4和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ①② | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Fe和0.1mol Zn被氧化,共转移电子0.2mol | |
| B. | 标准状况下,22.4L N2和N2O4的混合物,含N原子2mol | |
| C. | 16g O2和O3的混合物,含电子8mol | |
| D. | 常温常压下,12g CO和12g N2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢的质量是1 g | B. | 1 mol CO的质量为28 g•mol-1 | ||
| C. | 阿伏加德罗常数等于6.02×1023 | D. | 3.01×1023个SO2分子约是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com