
【题目】利用如图装置,可以完成许多电化学实验。下列有关此装置的叙述中,正确的是
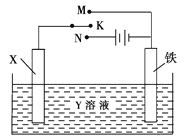
A.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中阳离子向碳棒电极移动
C.若X为碳棒,Y为硫酸铜溶液,开关K置于M处,碳棒质量将增加,此时外电路中的电子向碳电极移动
D.若X为铜棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
【答案】C
【解析】本题考查原电池和电解池原理。A.若X为铜棒,Y为硫酸铜溶液,开关K置于N处构成电镀池,铁棒作阴极,铜离子得电子生成铜,质量将增加,溶液中消耗的铜离子由阳极补充,浓度不变,错误;B.若X为碳棒,Y为NaCl溶液,开关K置于N处构成电解池,铁棒作阴极被保护,减缓铁的腐蚀,溶液中阳离子向阴极铁电极移动,错误;C.若X为碳棒,Y为硫酸铜溶液,开关K置于M处构成原电池,铁作负极,碳棒作正极,溶液中铜离子得到电子后变成铜附着在碳棒上,质量将增加,此时外电路中的电子向碳电极移动,正确;D.若X为铜棒,Y为NaCl溶液,开关K置于M处构成原电池,铁比铜活泼作负极,加快了铁的腐蚀,错误。故选C。


科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 3 mol·L-1的KClO3 B. 75 mL 2 mol·L-1的NH4Cl
C. 350 mL 3 mol·L-1的NaCl D. 150 mL 0.5mol·L-1的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 中和 100mL 1mol· L-1 的 H2SO4 溶液,需 NaOH 的质量为8g
B. 从 1 L 2mol· L-1 的 H2SO4 溶液中取出 0.5L,剩余溶液的浓度仍2mol· L﹣1
C. 制成 0.5L 10molL-1 的盐酸,需标准状况下氯化氢气体 112L
D. 1 L 水中溶解了58.5g NaCl,该溶液的物质的量浓度为 1mol· L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
(1)①1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是_______________________________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
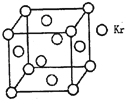
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 mol·L-1氨水中加入少量水,溶液中![]() 减少
减少
B. 将NH4Cl溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
C. 向氢氧化钠溶液中加入醋酸至中性,溶液中![]() =1
=1
D. 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法正确的是
A. 燃烧属于放热反应 B. 中和反应是吸热反应
C. 形成化学键时吸收能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法——“以火烧之,紫青烟起,乃真硝石也”。这是利用了
A. 升华 B. 氧化还原反应 C. 蒸馏 D. 焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中通入a mol X气体并发生反应:2X(g) ![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
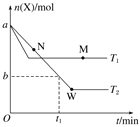
A. 正反应方向为放热反应
B. 在T2温度下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C. M点的正反应速率v正大于N点的逆反应速率v逆
D. W点时再加入一定量X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,下列有关电解质溶液的描述正确的是
A.等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH)c(H+)=c(![]() ) + c(H2SO3)
) + c(H2SO3)
B.pH相同的氨水和Ba(OH)2溶液中:2c(![]() )= c(Ba2+)
)= c(Ba2+)
C.等浓度的Na2SO4溶液与NH4Cl溶液等体积混合:c(Na+) +c(![]() )+c(NH3·H2O)=2c(
)+c(NH3·H2O)=2c(![]() ) +c(Cl)
) +c(Cl)
D.1 L 0.1 mol·L1的KAl(SO4)2·12H2O溶液中:c(K+)+c(Al3+)+c(H+)=c(OH)+c(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com