
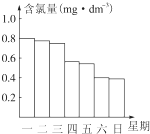
 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等. 2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;
2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;

科目:高中化学 来源: 题型:解答题
 MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.
MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
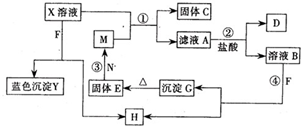 已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com