
| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:解答题
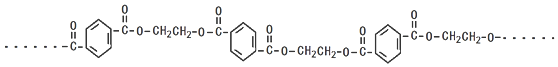
 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基.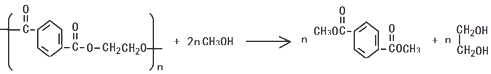 .
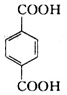
. )的原料.
)的原料.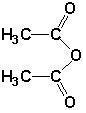 )反应生成阿司匹林的化学方程式:
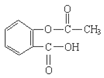
)反应生成阿司匹林的化学方程式: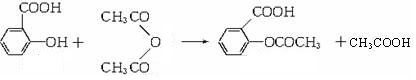 .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
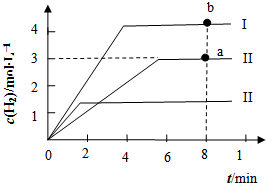 【化学-选修2化学与技术】
【化学-选修2化学与技术】| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
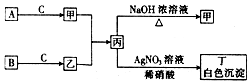 已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)
已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶中注入液体时,奖容量瓶的玻璃塞倒置在桌面上防止被污染 | |
| B. | 鉴别NO2和溴蒸汽时,将二者分别通到湿润的KI-淀粉试纸上观察颜色变化 | |
| C. | 将甲烷和乙烯的混合气体通入足量溴水,以除去乙烯 | |
| D. | 将洗净的滴定管放到烘箱中烘干,以加快干燥速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
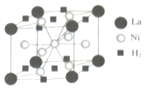 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: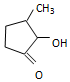 可形成配合物.
可形成配合物. 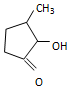 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
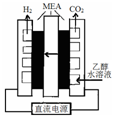 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电解质溶液中K+移向负极 | |
| B. | 放电时,电解质溶液的pH 不变 | |
| C. | 充电时,阴极的反应为:Zn(OH)42-+2e-=Zn+4OH- | |
| D. | 充电时,当有4.48L 氧气(标准状况下)释放出来时,则析出固体Zn为13g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com