
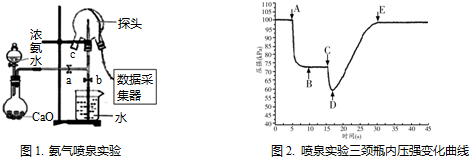
分析 (1)浓氨水易挥发,生石灰、碱石灰溶于水与水反应放出大量的热,能够促进氨气的逸出;氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色;
(2)三颈瓶内气体与外界大气压压强之差越大,其喷泉越剧烈.
解答 解:(1)浓氨水易挥发,生石灰、碱石灰溶于水与水反应放出大量的热,能够促进氨气的逸出,方程式为NH3•H2O+CaO=Ca(OH)2+NH3↑,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,
故答案为:NH3•H2O+CaO=Ca(OH)2+NH3↑;将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满(或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满);
(2)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,D点压强最小、大气压不变,所以大气压和C点压强差最大,则喷泉越剧烈,
故答案为:D.
点评 本题考查了氨气的制备和喷泉实验的设计、电离常数的计算,明确喷泉实验原理和氨气的性质是解题关键,注意电离平衡常数表达式的书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气 | B. | 一氧化碳 | C. | 氮气 | D. | 氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.1mol/L | B. | 1.5mol/L | C. | 1.2mol/L | D. | 1.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| B. | 醋酸除去水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 碳酸氢钠和偏铝酸钠反应:HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓ | |
| D. | 向硫酸铜中加入过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com