
| A. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| B. | 制蒸馏水时,应使温度计水银球雄近蒸馆烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上 |
分析 A.加热液体时应注意防止暴沸;
B.蒸馏时温度计用于测量馏分的温度;
C.分液时注意防止液体重新混合而污染;
D.过滤时注意避免滤纸破损.
解答 解:A.加热液体时在烧瓶内加几粒沸石,可防止暴沸,故 A正确;
B.蒸馏时温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口,故B错误;
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,防止液体重新混合而污染,故C正确;
D.过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上,避免滤纸破损,故D正确.
故选B.
点评 本题考查混合物分离提纯的方法及选择,为高频考点,侧重于学生的分析能力和实验能力的考查,把握物质的性质及性质差异为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| U | |||
| W | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | C. | 硫酸溶液、HCl | D. | 熔融的KNO3、酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
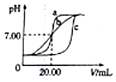 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )| A. | 乙组同学操作上的不足是在滴定终点附近测试和记录pH的间隔太大 | |
| B. | 甲组同学滴定时选用的滴定管为酸式滴定管 | |
| C. | 乙和丙两组同学的操作均存在不足或失误 | |
| D. | 丙组同学可能是用待测液润洗了锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是非电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在碱性条件下水解得到高级脂肪酸和甘油 | |
| B. | 乙酸和乙酸乙酯中都存在碳氧双键 | |
| C. | 酯化反应和酯的水解反应互为可逆反应 | |
| D. | 乙酸乙酯和油脂完全燃烧都只生成CO2和H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com