
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:戊<丁<丙 | |
| B. | 金属性:甲>丙 | |
| C. | 最高价氧化物水化物碱性:丙>丁>戊 | |
| D. | 最外层电子数:甲>乙 |
分析 根据各元素在周期表中的相对位置可知:甲为Li、丙为Na、乙为Be、丁为Mg、戊为Al,
A.同周期自左而右原子半径减小、电子层越多原子半径越大;
B.同主族元素中,原子序数越大,金属性越强;
C.同周期从左向右金属性减弱,同主族从上向下,金属性增强,金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.同一周期,原子序数越大,最外层电子数越多.
解答 解:根据各元素在周期表中的相对位置可知:甲为Li、丙为Na、乙为Be、丁为Mg、戊为Al,
A.同周期自左而右原子半径逐渐减小,则原子半径大小为:戊<丁<丙,故A正确;
B.同主族从上到下元素的金属性在增强,则金属性为甲<丙,故B错误;
C.Na、Mg、Al同周期,自左而右金属性减弱,故金属性Na>Ma>Al,最高价氧化物对应的水化物碱性:Na>Mg>Al,故C正确;
D.甲为Li、乙为Be,最外层含有电子数分别为1、2,最外层电子数:甲<乙,故D错误;
故选AC.
点评 本题考查位置、结构与性质关系及应用,题目难度不大,侧重对基础知识的巩固,注意掌握元素周期表的结构、元素周期律内容,试题有利于提高学生的逻辑推理能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、纯碱 | |
| C. | 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O2、CaO、MgO、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质均有颜色,随原子序数递增颜色加深 | |
| B. | HX随原子序数递增稳定性逐渐减弱 | |
| C. | 单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H-X-O | |
| D. | HX中除HF分子间存在氢键,其余HX分子均不存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
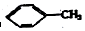 ②
②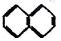 ③
③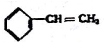 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦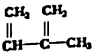 ⑧
⑧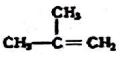
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

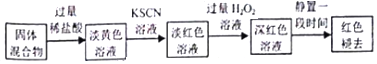
| 实验 | 操作 | 现象 | |
| 实验Ⅰ (取褪色后溶液3等份) | 第1份 | 滴加FeCl2溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
| 实验Ⅱ (取与褪色后的溶液同浓度的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+一定存在 | B. | 溶液中CO32-浓度为0.1 mol/L | ||
| C. | Cl-可能存在 | D. | Ba2+一定不存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com