

| FeSO4 | H2SO4 | BaCl2 | H2O2 | Al(NO3)3 | NaOH | |
| FeSO4 | \ | \ | 白色沉淀 | 浅绿色变黄褐色 | \ | 白色沉淀迅速变成灰绿色,最后变成红褐色 |
| H2SO4 | 、 | \ | 白色沉淀 | 气体 | \ | \ |
| BaCl2 | 白色沉淀 | 白色沉淀 | \ | \ | \ | \ |
| H2O2 | 浅绿色溶液变成黄褐色 | 气体 | \ | \ | \ | \ |
| Al(NO3)3 | \ | \ | \ | \ | \ | 滴加氢氧化钠时硝酸铝出现白色沉淀、反之无沉淀后有沉淀 |
| NaOH | 白色沉淀迅速变成灰绿色,最后变成红褐色 | \ | \ | \ | 滴加氢氧化钠时硝酸铝出现白色沉淀、反之无沉淀后有沉淀 | \ |


科目:高中化学 来源: 题型:阅读理解
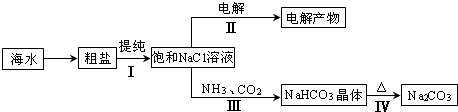
| ||
| ||
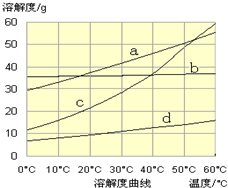
查看答案和解析>>
科目:高中化学 来源: 题型:
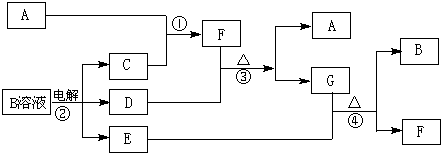
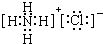
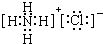
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)下图为常见仪器的部分结构(有的仪器被放大)A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____ (填字母标号)。
(2)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验 (“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。
③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_______ ,最后又变慢的原因是 。④请写出步骤三的操作内容 。⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2012学年山东省潍坊市高二寒假作业化学试卷(四) 题型:实验题
(1)下图为常见仪器的部分结构(有的仪器被放大)A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____ (填字母标号)。
(2)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验 (“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。
③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_______ ,最后又变慢的原因是 。④请写出步骤三的操作内容 。⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2012学年山东省潍坊市高二寒假作业化学试卷(四) 题型:实验题
(1)下图为常见仪器的部分结构(有的仪器被放大)A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____ (填字母标号)。
(2)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O

以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验 (“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。

③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_______ ,最后又变慢的原因是 。④请写出步骤三的操作内容 。⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com