
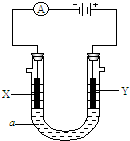
(19分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液c ;A、B是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
① B是 极(填“阴”或“阳”) B极逸出 (填:黄绿或无色)气体,同时B极附近溶液呈 色。
② 电解池中A极上的电极反应式为 。
B极上的电极反应式为 。
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
① A电极的材料是 ,电极反应式是 。
② B电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
②下列说法正确的是________。
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为12.8 g ,则阳极上产生的气体在标准状况下的体积为 L 。
(4)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用 ,阳极材料是用 ,阴极电极反应式为 。
(共19分)(电极方程式2分其余各1分) (1)① 阴极、 无色、 红
② 2Cl--2 e- === Cl2↑ 、2H++ 2e-=== H2↑或2 H2O+ 2e- = H2↑+2OH-
(2)① 粗铜、Cu-2e-=== Cu2+ ② 精铜、Cu2++2e-===Cu ③ b、d
(3)2.24 (4)H2SO4(aq)、 Cu、 O2 +2 H2O+ 4e- = 4OH- (物质用文字叙述也可以)
【解析】(1)①根据电流方向可知,a是正极,b是负极。B电极和电源负极相连,是阴极,溶液中的氢离子得到电子生成氢气。由于氢离子放电,破坏了阴极周围水的电离平衡,所以阴极溶液显碱性,即溶液显红色。
②A电极是阳极,溶液中的氯离子放电生成氯气,反应式为2Cl--2 e- === Cl2↑,阴极反应式是2H++ 2e-=== H2↑。
(2)粗铜精炼时,粗铜和电源的正极相连,纯铜和电源的负极相连,所以阴极和阳极的电极反应式分别是Cu2++2e-===Cu、Cu-2e-=== Cu2+;在电解过程中,部分电能转化为热能,所以a不正确。锌、铝的金属性强于铜的,首先失去电子。Ag、Pt、Au等金属性弱于铜的,形成阳极泥,所以选项bd正确,溶液中Cu2+向阴极移动,c不正确,答案选bd。
(3)生成铜是0.2mol,转移电子是0.4mol,所以根据电子的得失守恒可知,阳极生成氧气是0.1mol,标准状况下的体积是2.24L。
(4)根据总反应式可知,铜失去电子,氧气得到电子,所以阳极材料是铜。电解质溶液是稀硫酸。阴极是溶液中的氧气得到电子,反应式是O2 +2 H2O+ 4e- = 4OH- 。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com