
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
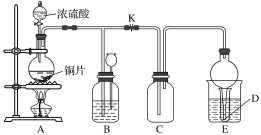
实验中某同学将a g铜片和12 mL 18 mol·L-1的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓硫酸反应的化学方程式:_____________________________。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是______________________。
实验装置E中D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)______________。
装置B的作用是储存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是____________________。B中应放置的液体是________(填字母)。
A 饱和Na2SO3溶液 B 酸性KMnO4溶液 C 浓溴水 D 饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸还未能使Cu完全溶解。你认为原因是______________________。
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是________(填字母)。
A Fe B BaCl2溶液 C Ag D Na2CO3溶液
(4)实验中该同学向A中反应后溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是__________(填名称),反应的化学方程式是__________________________________。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 品红溶液褪色 用浸有NaOH溶液的棉花团塞在试管口 广口瓶中液面下降,长颈漏斗中液面上升 D 随着H2SO4的消耗,浓H2SO4浓度逐渐变稀,稀硫酸与铜不反应 AD 氧气 2Cu+2H2SO4+O2
CuSO4+SO2↑+2H2O 品红溶液褪色 用浸有NaOH溶液的棉花团塞在试管口 广口瓶中液面下降,长颈漏斗中液面上升 D 随着H2SO4的消耗,浓H2SO4浓度逐渐变稀,稀硫酸与铜不反应 AD 氧气 2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
【解析】
(1)Cu与浓H2SO4反应需加热;
(2)SO2能使品红溶液褪色,为防止环境污染,可用的简单方法是用浸有NaOH溶液的棉花团塞在试管口;
A、Na2SO3+H2O+SO2=2NaHSO3;
B、KMnO4氧化SO2;
C、Br2+SO2+2H2O===2HBr+H2SO4;
D、SO2难溶于饱和NaHSO3溶液;
(3)随着反应的进行浓H2SO4浓度降低,变为稀H2SO4,Cu与稀H2SO4不反应;
(4)根据题目要求气体单质应为强氧化剂,且仅生成CuSO4溶液,该氧化剂为O2。
(1)Cu与浓H2SO4反应需加热,反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)SO2能使品红溶液褪色,为防止环境污染,可用的简单方法是用浸有NaOH溶液的棉花团塞在试管口,即SO2+2NaOH=Na2SO3+H2O。关闭K装置内气体压强增大,B广口瓶内液面下降,长颈漏斗内液面上升;B中的液体应不能与SO2反应,而且要防止SO2的溶解;
A、亚硫酸钠溶液能吸收SO2,发生的反应为Na2SO3+H2O+SO2=2NaHSO3;
B、KMnO4氧化SO2;
C、溴水能吸收SO2,发生的反应为Br2+SO2+2H2O=2HBr+H2SO4;
D、SO2难溶于饱和NaHSO3溶液。
答案选D;
(3)随着反应的进行浓H2SO4浓度降低,变为稀H2SO4,Cu与稀H2SO4不反应。检验余酸实质是检验H+的存在。Fe+2H+=Fe2++H2↑(现象为产生大量气泡),CO32-+2H+=H2O+CO2↑(现象为产生大量气泡),Fe和Na2CO3溶液能证明H+的存在;BaCl2溶液不能证明H2SO4剩余,因为产物CuSO4也能电离出SO42-;Ag与H+不反应,不能证明H+的存在。
答案选AD;
(4)根据题目要求气体单质应为强氧化剂,且仅生成CuSO4溶液,该氧化剂为O2,反应的化学方程式为2Cu+2H2SO4+O2![]() 2CuSO4+2H2O。
2CuSO4+2H2O。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】2014年,全国很多地区都曾出现严重的雾霾天气,汽车尾气、冬季取暖排放的CO2等都是形成雾霾的因素。请回答下列问题:
将不同物质的量的H2O(g)和CO分别通入容积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到3组数据如表所示:
CO2(g)+H2(g),得到3组数据如表所示:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
H2O | CO | CO | H2 | |||
1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
3 | 900 | a | b | c | d | t |
(1)实验1中0~5min内,以v(CO2)表示的化学反应速率为______,此温度下的化学平衡常数为______,温度升高时化学平衡常数会_______(填“增大”“减小”或“不变”)。
(2)若a=2,b=1,则达到平衡状态时实验2中H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
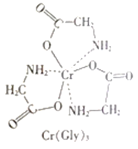
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
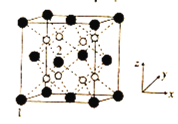
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的这段时间的平均速率为0.3 mol·L-1·s-1
②用物质B表示的这段时间的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为30%
④2 s时物质B的物质的量浓度为0.3 mol·L-1
其中正确的是
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为419.6℃,沸点907℃。
I.图是古代以炉甘石(ZnCO3)为原料炼锌的示意图。
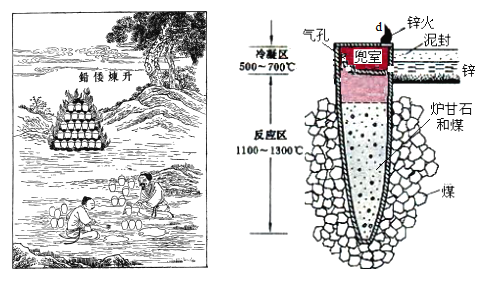
(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2计算时H3,还需要利用_________反应的H。
(2)泥罐中,金属锌的状态变化是_____;d口出去的物质主要是_______。
Ⅱ.现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2,还含铁等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
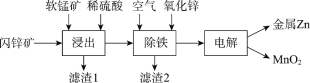
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 写出ⅱ的离子方程式:_________。
② 下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.________。
(4)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是_________。
(5)电解:用惰性电极电解时,阳极的电极反应是______。
(6)电解后的溶液中可循环利用的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钠元素,只需经过物理变化就可以得到金属钠
B.海水蒸发制得粗盐,经提纯后再电解盐溶液可以得到金属钠
C.从海水中提纯到的食盐,电解饱和食盐水产生的产物可以制得“84”消毒液(NaClO)
D.可以通过物理方法直接从海水中提取溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
A | 氨水 | CaO | 无 | 制取并收集氨气 |
|
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com