
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供。因其独特的放电方式,也称呼吸式电池。负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液。中间设有用于隔开正极和负极的锂离子固体电解质。正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合。如图所示。下列说法不正确的是
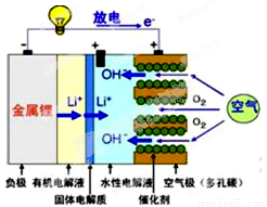
A.负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线。溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中。
B.正极反应:O2+2H2O+4e- =4OH- ,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环。
C.在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应。
D.锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止。
D
【解析】
试题分析:A、根据离子移动方向可知,锂失电子发生氧化反应而作负极,电极反应式为Li-e-=Li+,金属锂以锂离子(Li+)的形式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中,正确;B、正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环,正确;C、锂和水反应生成氢氧化锂和氢气,所以不能让金属锂与水性电解液直接接触,在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应,正确;D、在锂-空气电池中,由于放电反应生成的并非是固体的Li2O,而是容易溶解在水性电解液中的LiOH,错误,答案选D。
考点:考查原电池和电解池原理,正负极的判断


科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示:
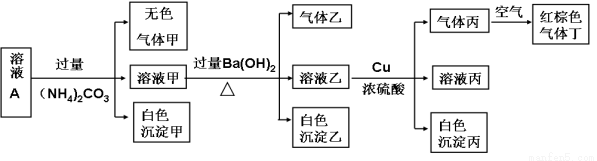
下列有关说法正确的是 ( )
A.沉淀乙一定有BaCO3,可能有BaSO4
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子
D.生成的甲、乙、丙气体均为无色的易溶于水气体
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
采用循环操作可以提高原料的利用率,下列工业生产中,没有采用循环操作的是( )
A.硫酸工业 B.氯碱工业 C.硝酸工业 D.合成氨工业
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:填空题
(12分) 化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX3)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由小到大的次序为 (填实验序号);
③与实验a相比,其他两组改变的实验条件及判断依据是:
b ;
c. 。
④用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如下图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是

A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐
B.用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml
C.将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
D.浓硝酸必须保存在棕色玻璃瓶中;钠必须保存在煤油中
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | 浓盐酸 | HCl | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:填空题
(12分)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+ 的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
A.稳定性:甲>乙,沸点:甲>乙 B.稳定性:甲>乙,沸点:甲<乙
C.稳定性:甲<乙,沸点:甲<乙 D.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为 。
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为 ,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com