
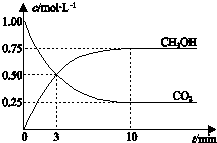
| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
分析 A.该反应的正反应是放热反应,升高温度平衡逆向移动;
B.反应达到平衡状态时,CO2的平衡转化率=$\frac{(1.00-0.25)mol}{1.00mol}×100%$;
C.3min时,该反应没有达到平衡状态,根据图知,该反应向正反应方向进行,所以正反应速率大于逆反应速率;
D.从反应开始到平衡,υ(CO2)=$\frac{\frac{(1.00-0.25)mol}{1L}}{10min}$=0.075 mol•L-1•min-1,同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比.
解答 解:A.该反应的正反应是放热反应,升高温度平衡逆向移动,甲醇的物质的量浓度减小、二氧化碳物质的量浓度增大,所以升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 减小,故A错误;
B.反应达到平衡状态时,CO2的平衡转化率=$\frac{(1.00-0.25)mol}{1.00mol}×100%$=75%,故B正确;
C.3min时,该反应没有达到平衡状态,根据图知,该反应向正反应方向进行,所以正反应速率大于逆反应速率,则CO2的浓度表示的正反应速率与CH3OH的浓度表示的逆反应速率不等,故C错误;
D.从反应开始到平衡,υ(CO2)=$\frac{\frac{(1.00-0.25)mol}{1L}}{10min}$=0.075 mol•L-1•min-1,同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比,所以υ(H2)=3υ(CO2)=3×0.075 mol•L-1•min-1=0.225mol•L-1•min-1,故D错误;
故选B.
点评 本题以图象分析为载体考查化学平衡计算、外界条件对化学平衡移动影响等知识点,注意图中3min时两线相交点不是平衡点,所以正逆反应速率不等,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol S与足量Fe反应,转移的电子数为3NA个 | |
| B. | 1.5 mol NO2与足量H2O反应,转移的电子数为2NA个 | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA个 | |
| D. | 100 ml 0.10mol/L的氨水中,含NH3•H2O 分子0.01NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶常用于作干燥剂 | |
| B. | 氢氟酸可以用来刻蚀玻璃 | |
| C. | 实验室盛装NaOH溶液的试剂瓶用玻璃塞 | |
| D. | 硅酸钠的水溶液俗称水玻璃,可用于制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 医学上了利用银镜反应来检验患者尿液中葡萄糖含量是否偏高 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:实验题
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含 量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
(1)滴定时应选用  作指示剂;
作指示剂;
(2)判断到达滴定终点的实验现象是  。
。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴 定前有气泡,滴定后气泡消失
定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加 入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·
入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol· L-1的盐酸标准液进行滴定,相关数据记录如下:
L-1的盐酸标准液进行滴定,相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.80 | 21.00 |
2 | 20.00 | 1.00 | 20.80 |
3 | 20.00 | 0.20 | 22.80 |
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 。(小数点后保留两位数字)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应A(g)+3B(g)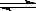 2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
A.v(D)=0.05mol/(L•min) B.v(B)=0.15mol/(L•min)
C. 3v(B)=2v(C) D.A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com