
| A、电离度可以表示弱电解质的相对强弱,它是已电离的电解质浓度占未电离分子浓度的百分比 |
| B、对同一弱电解质一般是浓度越小,温度越高,电离度越大 |
| C、pH=3的一元酸HA酸溶液稀释100倍后pH=5 |
| D、弱电解质的电离度随溶液的稀释而增大,溶液的导电性不断增强 |
| 已电离的电解质分子数 |
| 溶液中原有电解质的总分子数 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、溶液中的PH值都增大 |
| B、溶液的导电能力都减弱 |
| C、加水稀释时,KW不变;加CH3COONa晶体时,KW增大 |
| D、加水稀释时,醋酸溶液中所有微粒浓度都减小(不考虑水分子浓度) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃氢气之前必须检验氢气的纯度 |
| B、使用胶头滴管时,应使滴管始终垂直向下,一般不得伸入容器内 |
| C、用酒精灯给烧瓶中的液体加热时,无须垫石棉网 |
| D、使用托盘天平称量物质时,应先将游码拨到刻度尺最左端,然后调节螺母将天平调平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O | ||||
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O | ||||
D、用惰性电极电解MgCl2溶液:2H2O+2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 264kJ?mol-1 |
| B、632kJ?mol-1 |
| C、316kJ?mol-1 |
| D、1 624kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 |
| B、检验溶液中是否含有Cl-:先滴加硫酸,再滴加AgNO3溶液 |
| C、检验溶液中是否含有SO42-:先滴加稀硫酸,再滴加BaCl2溶液 |
| D、检验溶液中是否含有K+:焰色反应(透过蓝色钴玻璃)观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
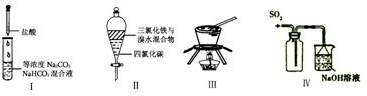
| A、实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B、实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C、实验Ⅲ:从饱和食盐水中提取NaCl晶体 |
| D、装置Ⅳ:既可防止倒吸,又更加有利于SO2的充分吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na-K合金常温下呈液态,可做核反应堆的导热剂 |
| B、Na2O和Na2O2其阴阳离子个数比相等,Na2O在空气中加热会变成淡黄色的Na2O2 |
| C、Na2CO3和NaHCO3的水溶液均显碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,其PH前者大 |
| D、Na2CO3和NaHCO3两固体可用加热法鉴别,Na2CO3和NaHCO3两溶液可滴加Ba(OH)2溶液来鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com