
| A. | 原子半径由大判小的顺序;Z>R>Y>W | |
| B. | X与Y形成化合物中一定含有离子键,可能含有共价键 | |
| C. | Y的氢化物比R的氢化物稳定,但Y的氢化物比R的氢化物熔沸点低 | |
| D. | RY2、WY2通入BaCl2溶液中均有白色沉淀生成. |
分析 X、Y、Z、W、R属于短周期主族元素,X的原子半径在短周期主族元素中最大,则X为Na元素;
Y元素的原子最外层电子数为m,次外层电子数为n,
Z元素的原子L层电子数为m+n,M层电子数为m-n,m+n=8,Y的次外层电子数为2,则n=2、m=6,
则Y为O元素、Z为Si元素;
W元素与Z元素同主族,则W为C元素;
R元素原子与Y元素原子的核外电子数之比为2:1,则R核外电子数为16,为S元素;
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.X和Y形成的化合物有Na2O、Na2O2;
C.元素的非金属性越强,其氢化物的稳定性越强,氢化物的熔沸点随着分子间作用力增大而增大,含有氢键的氢化物熔沸点较高;
D.SO2、CO2对应的酸亚硫酸、碳酸,其酸性都小于盐酸.
解答 解:X、Y、Z、W、R属于短周期主族元素,X的原子半径在短周期主族元素中最大,则X为Na元素;
Y元素的原子最外层电子数为m,次外层电子数为n,
Z元素的原子L层电子数为m+n,M层电子数为m-n,m+n=8,Y的次外层电子数为2,则n=2、m=6,
则Y为O元素、Z为Si元素;
W元素与Z元素同主族,则W为C元素;
R元素原子与Y元素原子的核外电子数之比为2:1,则R核外电子数为16,为S元素;
A.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,原子半径大小顺序是Na>Si>S>C>O,即X>Z>R>W>Y,故A错误;
B.X和Y形成的化合物有Na2O、Na2O2,这两种物质中都含有离子键,但只有过氧化钠含有共价键,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,氢化物的熔沸点随着分子间作用力增大而增大,含有氢键的氢化物熔沸点较高,Y的氢化物是H2O、R的氢化物是H2S,非金属性O>S,水中含有氢键、硫化氢中不含氢键,所以Y的氢化物比R的氢化物稳定,且Y的氢化物比R的氢化物熔沸点高,故C错误;
D.SO2、CO2对应的酸亚硫酸、碳酸,其酸性都小于盐酸,所以二氧化硫、二氧化碳都不和氯化钡溶液反应,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,涉及化学键、强酸制取弱酸、元素周期律等知识点,正确判断元素是解本题关键,注意氢化物稳定性只有化学键有关,氢化物的熔沸点与分子间作用力及氢键有关,易错选项是C.


科目:高中化学 来源: 题型:选择题
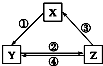 不能实现如图所示的变化的是( )
不能实现如图所示的变化的是( ) | 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Na2CO3 | NaOH | NaHCO3 | ④过量Ca(OH)2溶液 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| B. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 | |
| C. | C、H之间形成的是s-p σ键,C、C之间的π键是未参加杂化的2p轨道形成的 | |
| D. | C、C之间形成的是sp2-sp2σ键,C、H之间是未参加杂化的2p轨道形成的π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
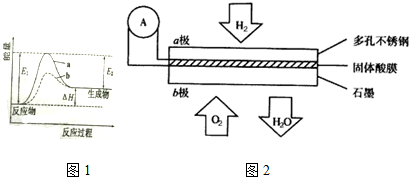
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
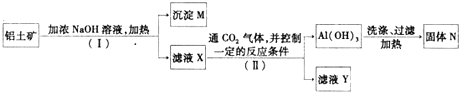
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
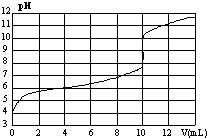 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com