
| A | C | |
| B |
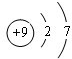 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,据此解答.
解答 解:A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素.
(1)由上述分析可知,A为N元素、B为S元素、C为F元素,故答案为:N;S;F;
(2)B为S元素,核外电子数为16,有3个电子层,最外层电子数为6,处于第三周期ⅥA族,故答案为:三;ⅥA;
(3)C为F元素,原子核外有9个电子,各层电子数为2、7,原子的原子结构示意图为 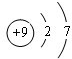 ;同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径S>F,故答案为:
;同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径S>F,故答案为: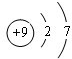 ;>;
;>;
(4)A的气态氢化物为NH3,B的最高价氧化物对应水化物为H2SO4,二者反应生成(NH4)2SO4,反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4.
点评 本题考查原子结构与元素周期表,难度不大,推断元素是解题关键,注意理解同主族元素原子序数关系.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 结构简式为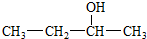 的有机物其名称为 2-丁醇 的有机物其名称为 2-丁醇 | |
| B. | 分子式为C4H8Br2结构中含一个一CH3的同分异构体(不考虑立体异构)有4种 | |
| C. | 某有机物球棍结构模型为: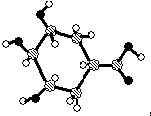 ,则该有机物能发生消去反应和氧化反应 ,则该有机物能发生消去反应和氧化反应 | |
| D. | 二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
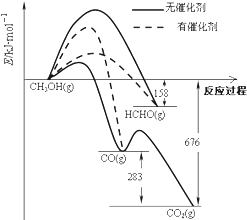 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
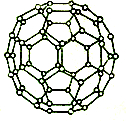 C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.
C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com