
| A、得到5.08g沉淀时,加入NaOH溶液的体积是600mL |
| B、该合金中铜与镁的物质的量之比是2:l |
| C、该浓硝酸中HNO3的物质的量浓度是14.0 mol?L-1 |
| D、NO2和N2O4的混合气体中,NO2的体积分数是80% |
| 2.04g |
| 17g/mol |
| 1000ρω |
| M |
| 1000×1.40×63% |
| 63 |
| n |
| c |
| V |
| Vm |
| 2.04g |
| 17g/mol |
| 1000ρω |
| M |
| 1000×1.40×63% |
| 63 |
| 1.28mol |
| 2mol/L |
| 1000ρω |
| M |
| 1000×1.40×63% |
| 63 |
| 2.24L |
| 22.4L/mol |
| 0.08mol |
| 0.1mol |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| 操 作 | 结 论 | |
| 甲 | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
| 乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
| 丙 | 分别加入到盛水的试管中 | 放热很显著的为浓硫酸 |
| 丁 | 分别用玻璃棒蘸浓氨水靠近盛酸的瓶口 | 冒白烟的为浓硫酸 |
| 戊 | 分别加到CuSO4?5H2O 晶体中 | 变白者为浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、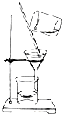 用如图所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
B、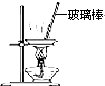 用如图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
C、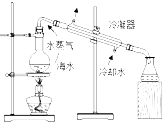 用如图所示装置从海水制取蒸馏水 |
D、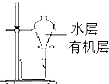 用如图所示装置分离酒精萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)>c(OH-)的任意水溶液 |
| B、加酚酞后显无色的溶液 |
| C、pH=6的某溶液 |
| D、能与金属Al反应放出H2的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A和甲是自石油和煤的两种基本化工原料,A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物,F是高分子化合物.相互转化关系如图所示(已知:R-CHO
A和甲是自石油和煤的两种基本化工原料,A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物,F是高分子化合物.相互转化关系如图所示(已知:R-CHO| 氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠可以保存在煤油或四氯化碳中 |
| B、钠长久露置在空气中最终生成NaHCO3 |
| C、钠在空气中燃烧,火焰黄色,生成淡黄色的Na2O2 |
| D、钠与水反应的实验现象可以说明钠硬度小、熔点低、密度小于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com