
| A. | 阴、阳离子通过静电吸引形成的强烈的相互作用 | |
| B. | 只由非金属元素组成的化合物不可能是离子化合物 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 只有活泼金属与活泼非金属之间才能形成离子键 |
分析 A.阴、阳离子通过静电作用所形成的化学键是离子键;
B、氯化铵是离子化合物;
C、氯化铝是金属元素与非金属元素化合时,是共价化合物;
D、铵根离子与酸根离也能形成离子键;
解答 解:A.阴、阳离子通过静电作用所形成的化学键是离子键,静电作用包含吸引力和排斥力,故A错误;
B、氯化铵只由非金属元素组成是离子化合物,故B错误;
C、氯化铝是金属元素与非金属元素化合时,是共价化合物,所以不一定形成离子键,故C正确;
D、活泼金属与活泼非金属之间能形成离子键,铵根离子与酸根离也能形成离子键,故D错误;
故选C.
点评 本题主要考查化学键的概念与化合物的关系,题目难度不大,注意离子键和共价键与化合物的关系是解题的关键.


科目:高中化学 来源: 题型:解答题
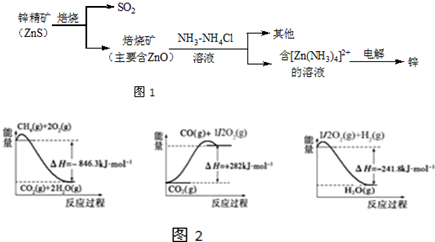
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的分子式 | B的分子式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应,一定是吸收能量的反应 | |
| B. | 在化学反应过程中总是伴随着能量的变化 | |
| C. | 释放能量的反应在常温下一定很容易发生 | |
| D. | 在确定的化学反应中反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
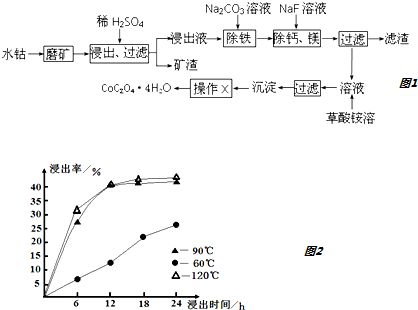
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强 | |
| B. | 为了消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质的形式存在 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保险要求 | |
| D. | 苯酚有杀菌和止痛作用,药皂中也掺有少量苯酚,所以可以用苯酚对环境消毒或直接涂抹于皮肤上进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com