

分析 (1)连接电源正极的电极为阳极,连接电源负极的电极为阴极,据此进行分析,考虑到溶液是碱性,要么是OH-参与反应,要么是反应生成OH-,据此写出阴极的电极方程式分析溶液的酸碱性;
(2)根据总反应分析,反应制备Na2FeO4,因此Fe电极是电极溶解,Fe在电解过程失去电子,生成FeO42-,据此写出电极反应式;
(3)①根据图象,电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是增大;
②当NaOH起始浓度为16mol/L,根据图象分析,1.0~2.0h内生成Na2FeO4的浓度增量为△c=16-8=8mol/L,根据化学反应平均速率计算公式:$\overline{r}=\frac{△c}{△t}$计算;
③从元素角度分析,总量Fe元素一定,A点产生的Na2FeO4的量比B点产生的Na2FeO4的量多,则A点的Fe(OH)3的量比B点的少,此时在浓碱溶解中,水解可以受到抑制;
(4)Na2FeO4易水解显碱性,因此洗涤Na2FeO4时需要抑制其水解,也就是需要使溶液保持碱性条件,可见只有醋酸钠是显碱性的;
(5)根据盖斯定律求解方程式的焓变.
解答 解:(1)与b相连的Fe极是Fe失电子发生氧化反应,则b是电源正极,a是电源负极,电解时,石墨电极是阴极,考虑到溶液是碱性,电极方程式应为2H2O+2e-=H2↑+2OH-,反应生成了OH-,则溶液的碱性增强,
故答案为:负;增强;
(2)反应制备Na2FeO4,因此Fe电极是电极溶解,Fe在电解过程失去电子,生成FeO42-,则Fe极的电极反应式应为Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;
(3)①根据图象,电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是增大,
故答案为:增大;
②根据图象,当NaOH起始浓度为16mol/L,根据图象分析,1.0~2.0h内生成Na2FeO4的浓度增量为△c=16-8=8mol/L,经历时间为△t=2.0-1.0=1.0h,则生成Na2FeO4的速率为$\overline{r}=\frac{△c}{△t}$=$\frac{8mol}{1h}$=8mol/(L•h),
故答案为:8;
③从元素角度分析,总量Fe元素一定,A点产生的Na2FeO4的量比B点产生的Na2FeO4的量多,则A点的Fe(OH)3的量比B点的少,
故答案为:<;
(4)考虑到Na2FeO4易水解显碱性,洗涤Na2FeO4时需要抑制其水解,也就是需要使溶液保持碱性条件,备选物质中,只有醋酸钠水解使溶液显碱性,符合要求,
故选C;
(5)已知:①2H2(g)+O2(g)═2H2O (1)△H1=akJ/mol,
②NaCl(aq)+H2O(1)═NaClO(aq)+H2(g)△H2=bkJ/mol,
③4Na2FeO4(aq)+10H2O(1)═4Fe(OH)3(s)+3O2(g)+8NaOH(aq)△H2=c kJ/mol,
所求反应为2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1),该反应可由$\frac{-③-3×①-6×②}{2}$得到,根据盖斯定律,所求反应的焓变为△H=$\frac{-△{H}_{3}-3△{H}_{1}-6△{H}_{2}}{2}$=$\frac{-c-3a-6b}{2}$kJ/mol.
故答案为:$\frac{-c-3a-6b}{2}$.
点评 本题考查化学原理部分知识,包含电解池,电解原理,电极反应式的书写,化学反应速率计算,盐类水解,热化学知识.题目考查综合,涉及的知识点较多,难度中等,是中档题.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题

| A. | 电解质溶液中的SO42-向b极移动 | |
| B. | 导线中有电子流动,电子从b极流到a极 | |
| C. | a极上发生了还原反应 | |
| D. | b极上有无色气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Pt周围的pH降低 | |
| B. | 当生成标准状况下22.4LH2时,转移的电子数为1.5 NA | |
| C. | 阳极反应式是Fe-6e-+8OH-═FeO42-+4H2O | |
| D. | 制得1mol Na2FeO4,有8molOH-从左向右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
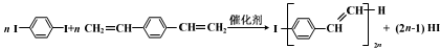
| A. | PPV 是聚苯乙烯 | |
| B. | PPV 难溶于水,易溶于乙醇等有机溶剂 | |
| C. |  属于芳香烃 属于芳香烃 | |
| D. | 1mo  最多可与5molH2发生反应 最多可与5molH2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的Zn与一定量的浓H2SO4反应,标况下产生22.4L气体,转移电子数一定为2NA | |
| B. | lmolC12参加反应转移的电子数一定为2NA | |
| C. | 将含0.lmolFeCl3的饱和溶液滴入一定量的沸水中得到Fe(OH)3胶体,其胶体微粒为0.lNA | |
| D. | 50mL,l2 mo1•L-1的盐酸与足量MnO2共热,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ⑤ | C. | ④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com