
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )

|
| A. | 30 min~40 min间该反应使用了催化剂 |
|
| B. | 反应方程式中的x=1,正反应为吸热反应 |
|
| C. | 30~40min改变的条件是将容器的体积扩大至原来的2倍 |
|
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
| 化学平衡建立的过程;物质的量或浓度随时间的变化曲线. . | |
| 专题: | 化学平衡专题. |
| 分析: | A.由图象可知,30min﹣40min之间,反应速率降低了,平衡不移动,反应物与生成物的浓度瞬时降低,催化剂不能改变浓度; B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1.则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应; C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,根据浓度变化计算体积扩大倍数; D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动. |
| 解答: | 解:A.由图象可知,30~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误; B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误; C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,A的浓度由1mol/L变为0.75mol/L,故体积变为原来的倍,故C错误; D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,故K2=K1.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动,平衡常数减小,故则K3<K2=K1,故D正确; 故选D. |
| 点评: | 本题考查化学平衡图象问题,题目难度较大,注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响反应速率的条件,本题易错,答题时注意思考,D选项注意根据54min平衡时浓度变化判断. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,
则该反应H>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )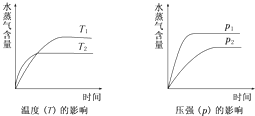
|
| A. | CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
|
| B. | CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
|
| C. | CH3CH2OH(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
|
| D. | 2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH═CH2(g)+2H2O(g);△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应:A(g)+3B(g)⇌2C(g),有关下列图象说法的不正确的是( )

|
| A. | 依据图a可判断正反应为放热反应 |
|
| B. | 在图b中,虚线可表示使用了催化剂 |
|
| C. | 若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
|
| D. | 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g•cm﹣3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
紫菜→(焙烧)→(浸取) (操作①)
(操作①) (操作②)→(蒸馏)→粗产品
(操作②)→(蒸馏)→粗产品
(1)实验室中焙烧紫菜用到的仪器有 CEF .
A.烧杯 B.蒸发皿 C.坩埚 D.试管 E.酒精灯 F.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式 2I﹣+H2O2+2H+═I2+2H2O .
(3)操作①的名称是 过滤 ;试剂A为 四氯化碳 (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
Ⅰ 乙醇与水互溶 ;
Ⅱ 裂化汽油能与碘发生加成反应 .
(4)操作②应在 分液漏斗 (仪器名称)中振荡、静置,操作时先分离出的是 下层液体 .
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.碳酸钠的水解:CO +2H2OH2CO3+2OH-
+2H2OH2CO3+2OH-
B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O===AgOH↓+NH
C.用惰性电极电解氯化镁溶液:2Cl-+2H+ H2↑+Cl2↑
H2↑+Cl2↑
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol•L-1FeCl2溶液:H+、Na+、Cl-、NO3-
B.c(OH-)=0.1 mol•L-1的溶液:K+、Na+、ClO-、NO3-
C.c(H+)=0.1 mol•L-1的溶液:K+、Na+、HCO3-、SO42-
D.与铝反应产生大量氢气的溶液:Ba2+、Na+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
金属单质及其化合物与工农业生产、日常生活有密切的联系。
请回答下列问题:
(1) 一定温度下,氧化铁可以与一氧化碳发生如下反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=Q kJ·mol-1,
2Fe(s)+3CO2(g) △H=Q kJ·mol-1,
①该反应的平衡常数表达式K= ;
②该温度时,在2 L盛有Fe2O3粉末的密闭容器中通人CO气体,5 min后,生
成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
③达平衡后,若温度升高 的值增大,则Q 0(填“>”、“=”、“<”)。
的值增大,则Q 0(填“>”、“=”、“<”)。
 (2)依据氧化还原反应:Cu2+(aq)+Fe(s)= Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
(2)依据氧化还原反应:Cu2+(aq)+Fe(s)= Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,X电极反应为:O2+2H2O+4e-  4OH-
4OH-
D.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com