
| A. | 玻璃属于非金属材料,其主要成分是碳酸盐 | |
| B. | 玻璃钢是一种复合材料,由塑料和铁丝复合而成 | |
| C. | 有机物合成材料属于高分子材料,在汽车轮胎、棉花、塑料制品中都存在 | |
| D. | 氮化硅陶瓷是新型无机非金属材料 |
分析 A.玻璃属于非金属材料,其主要成分是碳酸盐;
B.璃钢即纤维强化塑料,一般指用以玻璃纤维或其制品作增强材料的增强塑料;
C.有机物合成材料是有机小分子通过加成、缩聚反应形成的高分子材料,棉花属于天然高分子;
D.氮化硅属于无机非金属化合物.
解答 解:A.玻璃属于非金属材料,其主要成分是硅酸盐,不是碳酸盐,故A错误;
B.玻璃钢即纤维强化塑料,一般指用以玻璃纤维或其制品作增强材料的增强塑料,一般也可叫做玻璃纤维增强塑料,因此不是由塑料和铁丝复合而成,故B错误;
C.有机物合成材料是有机小分子通过加成、缩聚反应形成的高分子材料,在汽车轮胎、塑料制品中都存在,棉花中含有的是天然纤维不是合成材料,故C错误;
D.氮化硅是非金属元素N和Si形成的化合物,氮化硅属于无机非金属化合物,氮化硅陶瓷是新型无机非金属材料,故D正确.
故选D.
点评 本题考查了化学知识在生产生活中的应用,侧重于生产生活中化学材料的考查,题目难度不大,明确复合材料、无机非金属材料和新型无机非金属材料的组成是解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
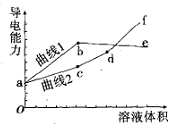 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

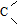 →-N=
→-N=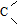 ;
;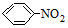 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$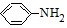 (易被氧化).请回答:
(易被氧化).请回答: ;
;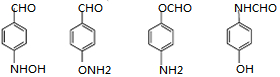 ;
;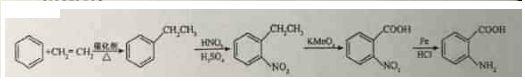 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目为0.4NA | |
| B. | 28g聚乙烯中所含原子数为6NA | |
| C. | 0.1mol苯乙烯中含有双键的数目为0.4NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com