
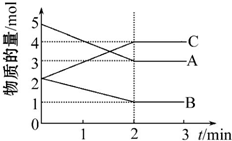
| A. | 3M(气)+2N(气)?P(气)+4Q(气) | B. | M(气)+2N(气)?3P(气)+Q(固) | ||
| C. | M(气)+N(气)?P(气) | D. | 以上都达到平衡 |
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| D. | 充电时阴极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | 只有③ |
查看答案和解析>>
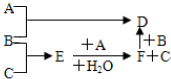
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
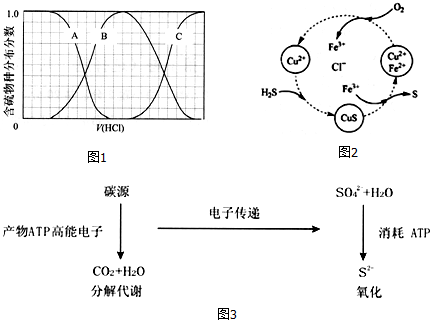
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ⑥ | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
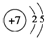 ,⑩的元素名称:溴
,⑩的元素名称:溴 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 盛放烧碱溶液不用玻璃塞的原因:SiO2+2OH-=SiO32-+H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 浓硝酸长期放置:4HNO3=4NO↑+3O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com