
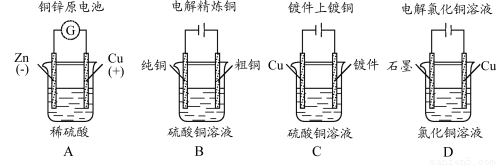
下列图示中关于铜电极的连接错误的是( )
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
用实验确定某酸HA是弱电解质。甲、乙两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(填“>”“<”或“=”),乙方案中,说明HA是弱电解质的现象是________(填序号)。
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处________。
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是 ( )
A.焓变 B.温度 C.压强 D.熵变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
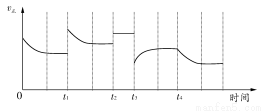
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )
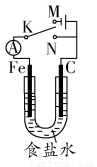
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
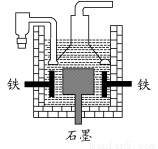
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融) 4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH
4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH 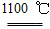 Fe3O4+2H2↑+4Na↑。下列有关说法正确的是 ( )
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是 ( )
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-=H2↑+O2↑
B.若用戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
C.吕萨克法制钠的原理是利用铁的还原性比钠强
D.目前工业上常用电解熔融氯化钠法制钠(如下图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
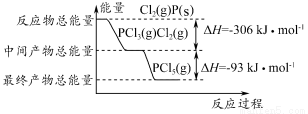
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ·mol-1
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K不变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:填空题
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
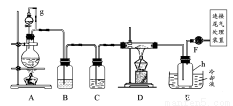
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温 度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式_________________________。
(2)装置E中的h瓶需要冷却的理由是_______________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000 × 10-2 mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com