
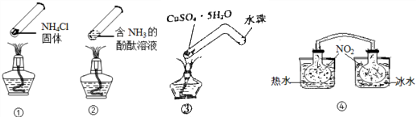
| A�� | ����ʱ�����ϲ��㼯�˹���NH4Cl��˵��NH4Cl������ | |
| B�� | ����ʱ������Һ��ɫ�䣬��ȴ���ָֻ�Ϊԭ������ɫ | |
| C�� | ����ʱ�����й�������ɫ��Ϊ��ɫ����ȴ���ָֻ�Ϊԭ������ɫ | |
| D�� | ���У���������ˮ�е�������������ɫ���˵������ʱ��Ӧ2NO2?N2O4���������ƶ� |
���� A������֤�Ȼ�淋ķֽ������ɣ�����������
B�����а����ķ�̪��ҺΪ��ɫ�����Ⱥ����ݳ�����Һ��Ϊ��ɫ����ȴ����Һ�ֻ���ɫ��
C�����ڼ������ɵ�ˮˮ�����䵼�ܴ�����ȴ��ˮ��������ͭ�Ӵ�����������ɫ����ָ���
D����������Ϊ����ɫ������������Ϊ��ɫ��������ɫ�����ƽ���������ɶ��������ķ����ƶ���
��� �⣺A������ʱ�����ϲ��㼯�˹���NH4Cl��˵��NH4Cl���Ȳ��ȶ����ֽ�����������»���ΪNH4Cl������֤�Ȼ�淋ķֽ������ɣ�������Ϊ�����仯����A����
B������ʱ�����ݳ�����Һ����ɫΪ��ɫ����ȴ�����ܽ���Һ��Ϊ��ɫ����B��ȷ��
C������ʱ������ͭ����ʧȥ�ᾧˮ������й�������ɫ��Ϊ��ɫ������ˮ�����䵼�ܴ�����ȴ����������ͭ�Ӵ�����ָ�Ϊԭ������ɫ����C����
D����������ˮ�е�������������ɫ���˵������ʱ��������Ũ������Ӧ2NO2?N2O4�������ƶ�����D����
��ѡB��
���� ���⿼���˻�ѧʵ��װ�õ��ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ����Ԫ�ؼ��仯��������Ϊ���ؼ���ע�����ջ�ѧʵ�������������������������ѧ���ķ�����������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H3��0 | |
| B�� | ������ȵ�б���ȶ� | |
| C�� | ��б��ת��Ϊ�����������ȷ�Ӧ | |
| D�� | �������ʱ����б�������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ס�������һ��Ϊ������ | |
| B�� | CO32-��Al3+��K+һ�������� | |
| C�� | SO42-��NH4+һ�����ڣ�NO3-��Cl-���ܲ����� | |
| D�� | ������Fe3+����һ������Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba��OH��2��Һ�еμ�NaHSO4��Һ�����ԣ�Ba2++2OH-+2H++SO${\;}_{4}^{2-}$�TBaSO4��+2H2O | |
| B�� | ���Ȼ�����Һ�ͷ�ˮ��Ӧ��ȡ�����������壺Fe3++3H2O����ˮ���TFe��OH��3��+3H+ | |
| C�� | ����ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� | |
| D�� | ����ʯ��ˮ��ϡ���ᷴӦ��Ca��OH��2+2H+=Ca2++2H20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1��NH4��2SO4��Һ����NH4+����c��S042-����c��H+������0H-�� | |
| B�� | Ũ�Ⱦ�Ϊ0.1 mol•L-1��Na2CO3��NaHCO3�������Ϻ����Һ����Na+����c��CO32-����c��HCO3-������0H-�� | |
| C�� | Ũ�Ⱦ�Ϊ0.1 mol•L-1NH3•H2O��NH4Cl�������Ϻ����Һ��c��Cl-����c��NH4+����c��NH3•H2O�� | |
| D�� | 0.1 mol•L-1��Na��2S��Һ����0H-��=c��H+��+c��HS-��+c��H2S�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | ��ʼʱ���������ʵ���/mol | ƽ��ʱ��Ӧ�е������仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�����a kJ |
| �� | 2 | 3 | 0 | �ų�����b kJ |
| �� | 2 | 6 | 0 | �ų�����c kJ |
| A�� | N2��ת���ʣ��ڣ��٣��� | B�� | ���������ڷ�Ӧ��ƽ�ⳣ�����ۣ��٣��� | ||
| C�� | ƽ��ʱ����������������٣��� | D�� | �ų�������ϵ��2a��c��184.8 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �� | C�� | �� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
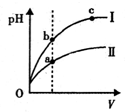
| A�� | ��Ũ��Ϊ0.1 mol•L-1 HF��Һ��ˮ����ϡ�����У�K��HF�����ֲ��� | |
| B�� | �����ʵ���Ũ�ȵ� NH4HSO4��Һ��NaOH��Һ�������ϣ���Һ�и�����Ũ�ȴ�С��ϵΪ��c��Na+��=c��SO42-����c��NH4+����c��H+����c��OH-�� | |
| C�� | ��֪298Kʱ�����ᣨHCN����Ka=4.9��10-10��̼���Ka1=4.4��10-7��Ka2=4.7��10-11���ݴ˿��Ʋ⽫��������뵽̼������Һ���ܹ۲쵽�����ݲ��� | |
| D�� | ij�¶��£���ͬ�������ͬpH������ʹ�����Һ�ֱ��ˮϡ�ͣ�pH����Һ���V�仯��������ͼ��ʾ��IIΪ����ϡ��ʱpH�ı仯���ߣ���a��b����ˮ�ĵ���̶ȣ�a��b |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com