
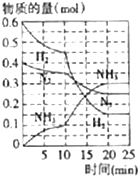
 氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:分析 (1)氨气的催化氧化生成一氧化氮和水,元素化合价升高失去电子做还原剂,被氧化生成氧化产物;
(2)某工业废水中含有Mg2+、Cu2+等离子.取一定量的该工业废水,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,$\frac{c(C{u}^{2+})}{c(M{g}^{2+})}$=$\frac{c(C{u}^{2+})}{c(M{g}^{2+})}$×$\frac{{c}^{2}(O{H}^{-})}{{c}^{2}(O{H}^{-})}$=$\frac{Ksp(Cu(OH)_{2})}{Ksp(Mg(OH)_{2})}$;
(3)热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算出1molNH3(g)分子中化学键断裂时需吸收的能量;
(4)①根据反应速率=$\frac{\frac{△n}{V}}{△t}$计算;
②根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
③温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化说明反应达到平衡状态时,物质的量不变;
④化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
解答 解:(1)用铂一铑合金网为催化剂,在氧化炉中(温度为800℃)进行氨催化氧化反应.4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,该反应的氧化产物为NO,
故答案为:一氧化氮;
(2)取一定量的该工业废水,工业废水中含有Mg2+、Cu2+等离子,向其中滴加烧碱溶液,
当Mg(OH)2开始沉淀时,$\frac{c(C{u}^{2+})}{c(M{g}^{2+})}$=$\frac{c(C{u}^{2+})}{c(M{g}^{2+})}$×$\frac{{c}^{2}(O{H}^{-})}{{c}^{2}(O{H}^{-})}$=$\frac{Ksp(Cu(OH)_{2})}{Ksp(Mg(OH)_{2})}$=$\frac{2.2×1{0}^{-20}}{1.8×1{0}^{-11}}$=1.2×10-9,
故答案为:1.2×10-9;
(3)已知反应N2(g)+3H2(g)?2NH3(g)的△H=-92.2kJ•mol-1,1mol-1N2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6Kj、436Kj的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为E,则得到944.6KJ+3×436KJ-2×E=-92.2KJ/mol,E=1172.4KJ,
故答案为:1172.4;
(4)①根据反应速率v(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.1-0)mol}{2L}}{10min}$=0.005mol/(L.min),
故答案为:0.005mol/(L.min);
②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,
故答案为:加了催化剂;10-20min内,N2、H2、NH3的物质的量变化大于0-10min内的变化程度,后10min的平均反应速率大于钱10min内的平均反应速率,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合;
③N2(g)+3H2?2NH3(g),反应为气体体积减小的放热反应,温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化说明反应达到平衡状态,
故答案为:是;反应为气体体积减小的反应,反应前后气体体积发生变化,温度和密闭容器的容积一定时,压强之比等于气体物质的量之比,压强不变说明反应达到平衡状态;
④由图象可以看出,当反应进行到时20-25min,各物质的量不变,说明反应达到平衡状态,化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,由图象可知,20min达平衡时,n(N2)=0.25mol,n(H2)=0.15mol,n(NH3)=0.3mol,所以所以其平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$,体积分数等于气体物质的量分数,
平衡时NH3的体积分数=$\frac{0.3mol}{0.25mol+0.15mol+0.3mool}$×100%=42.86%,
故答案为:$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$;42.86%;
点评 本题考查化学反应速率、化学平衡的计算、平衡移动以及平衡状态的判断、化学能量变化和键能的计算分析判断,注意对图象的分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
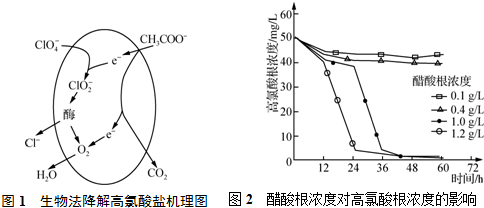
| 酸 | HClO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 1.6×10-9 | 4.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
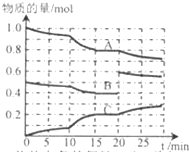 在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3HDO+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com