
①a mol ②b mol ③![]() mol ④
mol ④![]() mol ⑤0 mol ⑥(4a-b) mol
mol ⑤0 mol ⑥(4a-b) mol
A.①②④⑤⑥ B.①④⑤⑥
C.①②③⑤⑥ D.①③⑤
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源:2013届福建省罗源县第一中学高三第一次月考化学试卷(带解析) 题型:填空题
(18分)铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示: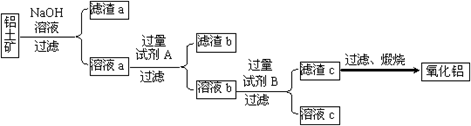
(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)加入NaOH溶液进行的反应的离子方程式为 ___、
,向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。每生产0.27吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C + N2 AlN + CO(配平)
AlN + CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三上学期期末考试化学试卷(解析版) 题型:填空题
I:化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。(1)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
D.酸性高锰酸钾溶液经常用盐酸酸化
(2)下列有关说法中正确的有??????? ?
①用pH试纸测得氯水的pH为3.5
②用瓷坩埚高温熔融NaOH固体
③加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
④向溶液中加入少量双氧水,再加几滴KSCN溶液后溶液变红,则原溶液中一定含有Fe2+
⑤实验时不慎被玻璃划破手指,引起轻微流血时,可用三氯化铁溶液涂抹止血
II:(1)某温度下,纯水中c(H+)=2.0×10-7mol·L-1.该温度下,0.9mol·L-1NaOH溶液与0.1mol·L-1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH= ???? 。
(2)向含有0.020 molCH3COOH的溶液中加入0.020mol CH3COONa固体,溶液pH增大,主要原因是 ?? ?? ;已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)?????? c(CH3COO-)(用“>”、“<”、“=”符号填空)。
(3)常温下,向100 mL 0.01mol·L-1HA溶液逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。

回答下列问题:
①由图中信息可知HA为??? 酸(填“强”或“弱”)。
②K点对应的溶液中,c(M+)+c(MOH)=???? mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三第一次月考化学试卷(解析版) 题型:填空题
(18分)铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
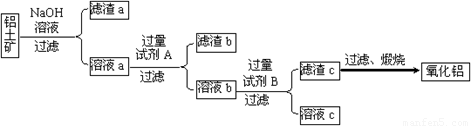
(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)加入NaOH溶液进行的反应的离子方程式为 ___、
,向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。每生产0.27吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C + N2  AlN + CO(配平)
AlN + CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3  AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
铝土矿的主要成分是![]() ,还含有
,还含有![]() 、
、![]() 等杂质。
等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为 ;每生产0.324吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: ![]()
![]()
![]()
![]()
![]() CO(请配平)
CO(请配平)
②氯化铝与氨气高温合成法:![]()
![]()
![]()
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com