
分析 (1)2MnO2+4KOH+O2=2K2MnO4+2H2O反应中Mn的化合价升高,O元素的化合价降低;
(2)3NaClO3+10HCl(浓)=3NaCl+4Cl2↑+2ClO2↑+5H2O反应NaClO3中Cl元素的化合价降低,HCl中Cl元素的化合价升高,结合氧化还原反应的概念分析.
解答 解:(1)2MnO2+4KOH+O2=2K2MnO4+2H2O反应中Mn的化合价升高,则MnO2被氧化,MnO2作还原剂,O元素的化合价降低,则O2被还原,O2作氧化剂,反应中转移4个电子,则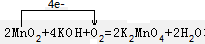 ;
;
故答案为:O2;MnO2;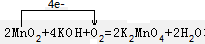 ;
;
(2)3NaClO3+10HCl(浓)=3NaCl+4Cl2↑+2ClO2↑+5H2O反应NaClO3中Cl元素的化合价降低,被还原,则NaClO3为还原剂,HCl中Cl元素的化合价升高,被氧化,则HCl为还原剂,反应中转移电子数为7,则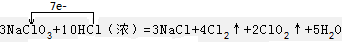 ;
;
故答案为:HCl;NaClO3; .
.
点评 本题考查氧化还原反应,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:多选题
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com